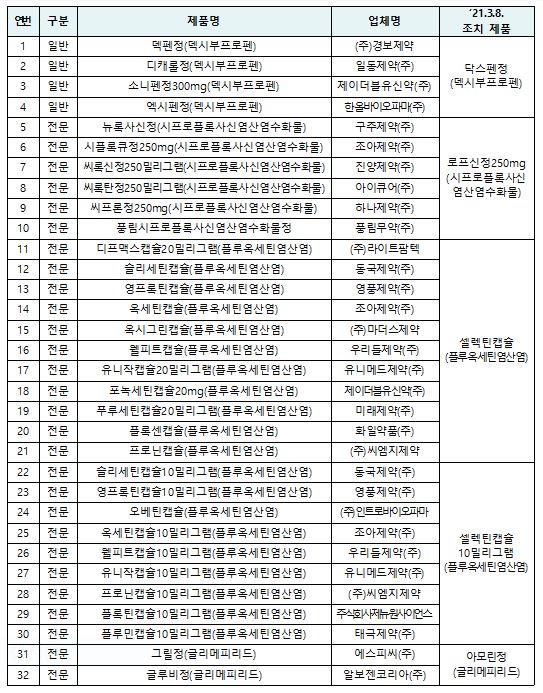
▲잠정 제조‧판매 중지 대상 의약품 (24개사 32품목) (사진제공=식약처)
허가 또는 신고된 사항과 다르게 제조돼 잠정적으로 판매중지ㆍ회수 조치된 바이넥스 의약품이 기존 6개에서 32개 품목으로 확대됐다.
식품의약품안전처는 의약품 제조업체 바이넥스에 대한 현장 조사를 진행 중인 가운데 전날 발표한 6개 품목에 더해 해당 제조소가 수탁 제조하는 24개사 32개 품목에 대해서도 잠정 제조ㆍ판매중지 및 회수 조치한다고 9일 밝혔다.
이번 조치는 바이넥스에 대한 현장 조사 진행 중 앞서 잠정 제조ㆍ판매 중지 등 조치된 품목과 같은 방법으로 제조하는 다른 제약업체의 32개 품목을 확인하면서 결정했다. 이번 조치 대상 품목은 생산실적 비중이 높지 않아 국내 수급에는 영향이 없을 전망이다.
앞서 바이넥스는 허가 또는 신고된 사항과 다르게 제조한 해당 품목에 대한 회수 계획을 부산지방식약청에 제출했다. 이에 식약처는 예방적 차원에서 이번 조치를 결정했고, 해당 제조소의 제조ㆍ품질관리 전반을 확인하기 위해 조사를 실시했다.
식약처는 의‧약사 등 전문가에게 해당 제품을 다른 대체 의약품으로 전환하고 제품 회수가 적절히 수행될 수 있도록 협조를 요청하는 안전성 속보를 의‧약사 및 소비자원 등 관련 단체에 배포하고 보건복지부 및 건강보험심사평가원을 통해 병·의원 등에 해당 제품에 대한 처방 제한을 요청했다.

![잠자던 내 카드 포인트, ‘어카운트인포’로 쉽게 조회하고 현금화까지 [경제한줌]](https://img.etoday.co.kr/crop/140/88/2100528.jpg)
!['20년 째 공회전' 허울 뿐인 아시아 금융허브의 꿈 [외국 금융사 脫코리아]](https://img.etoday.co.kr/crop/140/88/2100022.jpg)
![[단독]"한 번 뗄 때마다 수 백만원 수령 가능" 가짜 용종 보험사기 기승](https://img.etoday.co.kr/crop/140/88/2100020.jpg)
![8만 달러 터치한 비트코인, 연내 '10만 달러'도 넘보나 [Bit코인]](https://img.etoday.co.kr/crop/140/88/2100256.jpg)

![환자복도 없던 우즈베크에 ‘한국식 병원’ 우뚝…“사람 살리는 병원” [르포]](https://img.etoday.co.kr/crop/140/88/2099863.jpg)
![불 꺼진 복도 따라 ‘16인실’ 입원병동…우즈베크 부하라 시립병원 [가보니]](https://img.etoday.co.kr/crop/140/88/2099872.jpg)
![“과립·멸균 생산, 독보적 노하우”...‘단백질 1등’ 만든 일동후디스 춘천공장 [르포]](https://img.etoday.co.kr/crop/140/88/2099348.jpg)














![잠자던 내 카드 포인트, ‘어카운트인포’로 쉽게 조회하고 현금화까지 [경제한줌]](https://img.etoday.co.kr/crop/300/170/2100528.jpg)
![코스피 1% 이상 하락... 2531.66에 마감 [포토]](https://img.etoday.co.kr/crop/300/190/2100641.jpg)