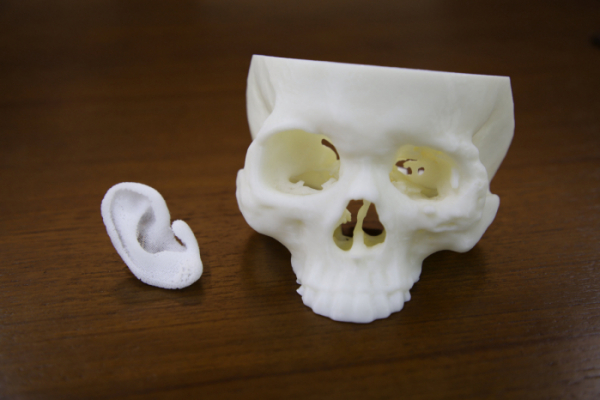
3D 바이오프린팅 전문 기업 티앤알바이오팹이 외측성 소이증 환자를 대상으로 하는 귀 재건용 환자맞춤형 생분해성 인공지지체(임플란트, 제품명 ‘티앤알 벨라포어-E’)에 대해 식품의약품안전처에서 임상시험계획(IND)을 승인받았다고 28일 밝혔다.
이에 따라 티앤알바이오팹은 강남세브란스병원 성형외과 윤인식 교수팀과 해당 인공지지체의 연구자 주도 탐색 임상시험을 진행할 계획이다. 이로써 환자맞춤형 귀 재건용 생분해성 인공지지체를 임상에 적용하는 국내 최초 사례가 된다.
소이증(小耳症, microtia)은 선천적으로 한쪽 또는 양쪽의 귀가 정상보다 훨씬 작고 모양이 변형된 상태의 질환이다. 소아 6000명 중 1명 수준으로 발생하고 두 귀 중 한쪽 귀가 저성장 상태인 외측성 소이증이 일반적이다.
소이증 치료를 위해 기존에는 환자 본인의 가슴연골 또는 비흡수성 재료를 이용해 귀에 이식하는 수술 방법이 주로 쓰였다. 그러나 이 수술법들은 환자의 가슴연골을 적출해야 하는 부담감이나 기존 비흡수성 재료로 유발되는 염증 반응 문제 등 임상적 한계가 지적돼왔다.
티앤알바이오팹의 환자맞춤형 귀 재건용 인공지지체는 독자적인 3D 바이오프린팅 기술로 소이증 환자의 정상 귀와 동일하게 설계ㆍ제작되며, 특히 생분해성(생체흡수성) 재료를 사용해 이식 후에는 인공지지체가 서서히 분해되면서 환자 본인의 조직으로 대체된다는 것이 장점이다. 또 임상 개발이 완료되면 소아 소이증 환자에게도 기존 수술법 대비 더욱 효과적으로 활용될 수 있을 것으로 기대된다.
티앤알바이오팹과 강남세브란스병원은 외측성 소이증을 갖고 있는 성인 환자 대상의 연구자 주도 임상을 통해 종래의 수술 방법을 재평가하고, 환자맞춤형 귀 재건용 생분해성 인공지지체의 유효성과 안전성을 확인하는 연구를 진행할 계획이다.
티앤알바이오팹 연구진는 “이번 IND 승인은 식약처와의 3년에 걸친 긴밀한 논의 끝에 이룬 의미 있는 성과”라며 “환자맞춤형 귀 재건용 생분해성 인공지지체의 국내 첫 임상을 통해 외측성 소이증 환자의 삶의 질 향상에 기여할 수 있는 새로운 치료법을 개발하는 계기를 마련하겠다”라고 말했다. 이어 “특히, 수술이 어려웠던 소아 환자들에게도 효과적인 치료의 길이 열릴 것으로 기대한다”라고 덧붙였다.
티앤알바이오팹은 3D 바이오프린팅 기술을 기반으로 △생분해성 의료기기 △조직ㆍ장기 바이오프린팅을 위한 바이오 잉크 △체외 시험을 위한 오가노이드 △3D프린팅 세포 치료제를 연구개발 및 생산하는 기업이다.

![잠자던 내 카드 포인트, ‘어카운트인포’로 쉽게 조회하고 현금화까지 [경제한줌]](https://img.etoday.co.kr/crop/140/88/2100528.jpg)
![긁어 부스럼 만든 발언?…‘티아라 왕따설’ 다시 뜨거워진 이유 [해시태그]](https://img.etoday.co.kr/crop/140/88/2100644.jpg)
![[단독]"한 번 뗄 때마다 수 백만원 수령 가능" 가짜 용종 보험사기 기승](https://img.etoday.co.kr/crop/140/88/2100020.jpg)
![8만 달러 터치한 비트코인, 연내 '10만 달러'도 넘보나 [Bit코인]](https://img.etoday.co.kr/crop/140/88/2100256.jpg)

![환자복도 없던 우즈베크에 ‘한국식 병원’ 우뚝…“사람 살리는 병원” [르포]](https://img.etoday.co.kr/crop/140/88/2099863.jpg)
















![긁어 부스럼 만든 발언?…‘티아라 왕따설’ 다시 뜨거워진 이유 [해시태그]](https://img.etoday.co.kr/crop/300/170/2100644.jpg)
![코스피 1% 이상 하락... 2531.66에 마감 [포토]](https://img.etoday.co.kr/crop/300/190/2100641.jpg)