코로나19 백신 도입을 앞두고 식품의약품안전처가 백신의 보관ㆍ수송 관리를 강화한다. 백신의 보관, 수송 과정에서 냉장ㆍ냉동 기록을 2년간 보관하게 함으로써 품질 유지에 힘쓰겠다는 계획이다.
식품의약품안전처는 생물학적 제제 등의 보관ㆍ수송 관리 강화를 위해 ‘생물학적 제제 등의 제조ㆍ판매관리 규칙’ 개정안을 29일 입법예고하고 내년 2월 8일까지 의견을 받는다고 밝혔다.
생물학적 제제 등은 사람이나 다른 생물체에서 유래된 것을 원료 또는 재료로 해 제조한 의약품으로, 보건위생상 특별한 주의가 필요한 제제다. 종류는 백신, 혈액제제ㆍ혈장분획제제, 유전자재조합의약품, 세포치료제, 유전자치료제 등이 있다.
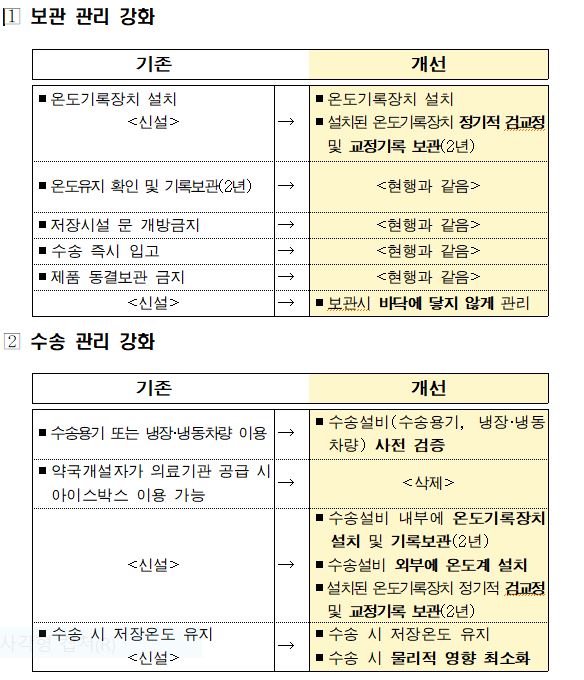
개정안의 주요 내용은 △보관 관리 강화 △수송 관리 강화 △출하증명서 개선 등이다.
보관 관리를 강화하기 위해 판매자는 생물학적 제제 등을 바닥에 직접 닿지 않게 두어야 하고, 냉장ㆍ냉동 보관하는 경우 설치된 자동온도기록장치를 검ㆍ교정해야 하며 그 기록을 2년간 보관해야 한다.
수송 관리 강화의 경우 판매자가 생물학적 제제 등을 운송할 때 수송용기와 냉장ㆍ냉동차량 내부에 자동온도기록장치를 설치해야 한다. 수송과정에서 보관온도를 유지하는지 사전에 검증해야 하고, 수송 온도 기록을 2년간 보관해야 한다.
또 생물학적 제제 등의 수송과정에서 온도 유지 여부를 확인할 수 있도록 출하증명서 양식을 변경해야 한다. 판매자는 수령자에게 생물학적 제제 등을 인계할 때 온도를 기재하고 수령자의 서명을 받아 출하증명서를 직접 보관해야 한다. 수령자가 요청하면 그 사본을 제공해야 한다. 출하증명서는 관리가 쉽도록 전자문서 보관이 허용된다.
입법예고안에 대한 의견은 국민참여입법센터를 통해 온라인 제출하면 된다.
식약처는 “냉장ㆍ냉동 보관 등 취급에 주의가 필요한 생물학적 제제 등이 제조단계부터 유통ㆍ사용에 이르는 전 과정에서 품질이 유지돼 안전한 의약품이 공급될 수 있도록 관계 부처와 협력하고 지속해서 관리체계를 개선해 나가겠다”라고 말했다.

![잠자던 내 카드 포인트, ‘어카운트인포’로 쉽게 조회하고 현금화까지 [경제한줌]](https://img.etoday.co.kr/crop/140/88/2100528.jpg)
!['20년 째 공회전' 허울 뿐인 아시아 금융허브의 꿈 [외국 금융사 脫코리아]](https://img.etoday.co.kr/crop/140/88/2100022.jpg)
![[단독]"한 번 뗄 때마다 수 백만원 수령 가능" 가짜 용종 보험사기 기승](https://img.etoday.co.kr/crop/140/88/2100020.jpg)
![8만 달러 터치한 비트코인, 연내 '10만 달러'도 넘보나 [Bit코인]](https://img.etoday.co.kr/crop/140/88/2100256.jpg)

![환자복도 없던 우즈베크에 ‘한국식 병원’ 우뚝…“사람 살리는 병원” [르포]](https://img.etoday.co.kr/crop/140/88/2099863.jpg)
![불 꺼진 복도 따라 ‘16인실’ 입원병동…우즈베크 부하라 시립병원 [가보니]](https://img.etoday.co.kr/crop/140/88/2099872.jpg)
![“과립·멸균 생산, 독보적 노하우”...‘단백질 1등’ 만든 일동후디스 춘천공장 [르포]](https://img.etoday.co.kr/crop/140/88/2099348.jpg)













![잠자던 내 카드 포인트, ‘어카운트인포’로 쉽게 조회하고 현금화까지 [경제한줌]](https://img.etoday.co.kr/crop/300/170/2100528.jpg)
![코스피 1% 이상 하락... 2531.66에 마감 [포토]](https://img.etoday.co.kr/crop/300/190/2100641.jpg)