한미약품이 기술이전한 항암제 신약 후보물질인 '포지오티닙(poziotinib)'의 글로벌 임상2상(ZENITH20) 코호트2 연구 결과가 첫 공개됐다.
한미약품 파트너사 스펙트럼(Spectrum Pharmaceuticals)은 지난 19일 온라인으로 열린 '유럽종양학회(ESMO) Virtual Congress 2020'에서 exon20 삽입 변이(insertion mutation)을 가진 비소세포폐암(NSCLC) 대상 ZENITH20 임상 데이터를 발표했다.
한미약품에 따르면 스펙트럼은 코호트2 연구 결과를 바탕으로 FDA에 신약시판허가(NDA)를 위한 미팅 신청을 완료하는 등 포지오티닙의 신속한 허가를 위한 절차를 시작했다.
스펙트럼 프랑수아 레벨(Francois Lebel) CMO는 “이번 ESMO 발표는 포지오티닙의 글로벌 2상 코호트2 연구 결과를 전세계 의료 전문가들에게 처음 공개한 자리”라며 “현재까지 HER2 엑손20 삽입 변이 비소세포폐암 치료를 위해 승인된 치료제가 없는 만큼 이번 연구 결과를 바탕으로 허가를 위한 다양한 방안을 FDA와 논의하겠다”고 말했다.
이번에 발표한 코호트2 연구는 치료 전력이 있는 EGFR/HER2 엑손20 삽입 변이 비소세포폐암 환자 90명을 대상으로 하루 1회 포지오티닙 16mg 경구 투여 방식으로 진행됐다. 코호트2에 참여한 환자가 이전 받은 치료법의 중간값은 2회(1~6)다.
추적기간 중앙값 8.3개월이 된 시점에서 ITT(intention to treat) 분석 결과 전체 환자에게서 객관적반응률(ORR)은 27.8%(25/90명, 95% CI, 18.9%~38.2%), 질병통제율(DCR)은 70%(63/90명)였다. 또한 전체 환자의 74%인 67명에게서 종양 감소를 확인했으며, 종양 감소 중앙값은 22%였다.
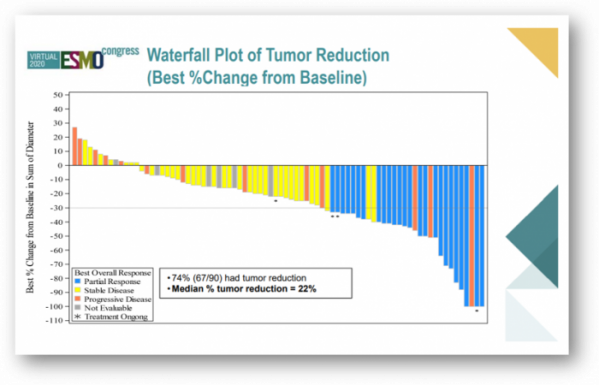
스펙터럼은 환자군을 좁혀 '평가가능한(evaluable) 환자'라고 명명한 74명에서 ORR은 35.1%, DCR은 82.4%이었다. 두 그룹 모두 약물 반응 지속기간의 중앙값(mDoR)은 5.1개월, 무진행 생존기간 중앙값(mPFS)은 5.5개월로 동일했다.
전체 환자의 14%(13명)에서 치료제 관련 중증 부작용이 나타났다. 3등급 이상 부작용으로 가려움증(30%), 설사(26%), 구내염/점막 염증(22%) 등이 빈번하게 발생했다. 4등급 부작용은 1건으로 구내염/점막 염증이 관찰됐다. 임상에서 12%(11명)는 부작용으로 치료를 중단했으며, 중간에 부작용으로 약물 투여를 조절하거나 용량을 줄인 환자는 87%, 78%이었다.
29명의 환자를 대상으로 한 해당 임상은 포지오티닙 16mg을 하루 1회 투여 또는 독성 발현 정도에 따라 투여 용량을 감경하는 방식으로 진행됐으며, 독성 발현에 따른 치료 중단 및 투여 용량 감경이 PFS와 ORR및 DCR에 영향을 미쳤다는 설명이다. 스펙트럼은 이 결과도 감안해 현재 진행중인 ZENITH20 임상 연구에서 포지오티닙 저용량 투여 및 투여 스케줄 조정을 진행하고 있다.
한편 이번 학회에서 스펙트럼은 말기 전이성 EGFR/HER2 엑손 20 삽입 변이 비소세포폐암 환자 대상 EAP 임상 연구 결과도 포스터 발표했다. EAP(Expanded Access Program)는 치료 목적 사용 승인 프로그램으로, 마땅한 치료 대안이 없는 말기 환자에게 임상 단계 약물을 투여할 수 있게 하는 제도를 말한다.

![긁어 부스럼 만든 발언?…‘티아라 왕따설’ 다시 뜨거워진 이유 [해시태그]](https://img.etoday.co.kr/crop/140/88/2100644.jpg)
![잠자던 내 카드 포인트, ‘어카운트인포’로 쉽게 조회하고 현금화까지 [경제한줌]](https://img.etoday.co.kr/crop/140/88/2100528.jpg)
![[단독]"한 번 뗄 때마다 수 백만원 수령 가능" 가짜 용종 보험사기 기승](https://img.etoday.co.kr/crop/140/88/2100020.jpg)
![8만 달러 터치한 비트코인, 연내 '10만 달러'도 넘보나 [Bit코인]](https://img.etoday.co.kr/crop/140/88/2100256.jpg)

![환자복도 없던 우즈베크에 ‘한국식 병원’ 우뚝…“사람 살리는 병원” [르포]](https://img.etoday.co.kr/crop/140/88/2099863.jpg)





!["한국은 '이것' 가능한 유일무이한 국가" 방산주 '이렇게' 투자할 때입니다 ㅣ 이영훈 이사 [찐코노미]](https://i.ytimg.com/vi/B9X9jpK5FGE/mqdefault.jpg)










![[찐코노미] "한국은 이것 가능한 유일무이한 국가"…방산주 '이렇게' 투자할 때](https://img.etoday.co.kr/crop/300/170/2100715.jpg)
![코스피 1% 이상 하락... 2531.66에 마감 [포토]](https://img.etoday.co.kr/crop/300/190/2100641.jpg)