
삼성바이오에피스가 아바스틴 바이오시밀러 ‘에이빈시오(Avinsio)’의 추가 임상 3상에서 오리지널과 등등한 효능을 확인했다. 에이빈시오는 지난 8월 유럽에서 판매승인을 받았다.
삼성바이오에피스는 15일 온라인으로 개최되는 유럽종양학회 정기학술대회(ESMO Virtual Congress 2020)에서 ‘에이빈시오’의 추가 임상 3상결과를 발표할 예정이라고 밝혔다. 삼성바이오에피스는 오는 17일(현지시간) e-포스터 형식으로 상세한 내용의 발표에 나선다.
삼성바이오에피스는 임상 3상에 참여했던 비소세포폐암(NSCLC) 환자 중 임상시험 프로토콜을 준수한 ‘순응 집단(PPS: per-protocol set)’으로 분류된 665명을 대상으로 ‘에이빈시오’와 오리지널 의약품인 ‘아바스틴’의 추가 비교 분석을 진행했다.
삼성바이오에피스는 최고 전체반응률에서 위험도차이와 종양크기의 최대변화율을 분석해 오리지널 의약품과 동등한 효능을 확인했다. 구체적으로 삼성바이오에피스는 24주간의 ‘최고 전체반응률(best ORR)’에서 유의미한 치료 경과를 확인할 수 있는 11주 및 17주차의 데이터를 분석했다. 그 결과, 11주 및 17주차에 에이빈시오와 아바스틴간 최고 전체반응률의 위험도차이(risk difference)는 각각 2.2%(95% CI: -4.6%~9.1%), 2.4%(95% CI: -5.1%~10.0%)로 유의미한 차이를 나타내지 않았다. 최고 전체반응률이란 특정 기간 동안 사전에 정해 놓은 범위 이상의 종양 감소를 보인 환자의 비율을 뜻한다.
그 다음, 기준점 대비 종양 크기의 ‘최대 변화율(maximum percentage change)’을 분석했다. 치료 시작 시점을 기준으로 각 주차별로 종양이 가장 크게 감소한 비율의 평균값을 구한 것으로, 에이빈시오와 아바스틴으로 치료받은 환자군에서 각각 -27.8%, -27.3%로 0.59%(p=0.7452) 차이를 나타내 유의미한 변화를 보이지 않았다.
삼성바이오에피스 관계자는 “임상 시험의 후속 연구를 통해 에이빈시오와 오리지널 의약품간 의학적 효능이 동등한 수준임을 다시 한 번 입증할 수 있게 되었으며, 당사 제품이 더 많은 환자들에게 합리적이고 효과적인 치료 대안이 될 수 있기를 기대한다”고 말했다.
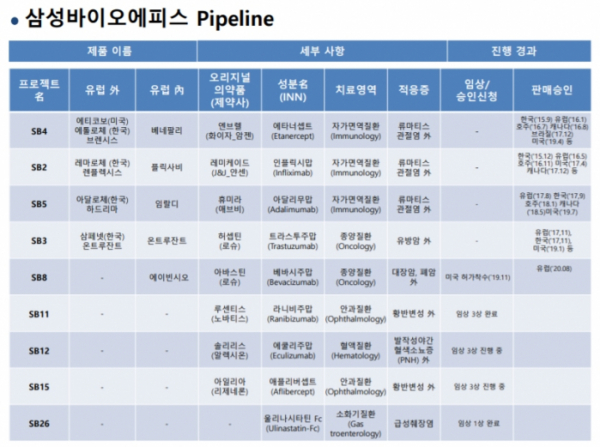
한편, ‘에이빈시오’는 지난 8월 유럽연합 집행위원회(EC: European Commission)로부터 판매 허가를 획득한 국내 최초의 ‘아바스틴(AVASTIN®)’ 바이오시밀러다. 삼성바이오에피스는 마케팅 파트너사인 미국 머크(MSD)와 함께 유럽 주요 5개국(EU5: 독일, 영국, 프랑스, 이탈리아, 스페인)을 중심으로 에이빈시오의 본격적인 판매 체제에 돌입했다.
현재 삼성바이오에피스는 유럽 시장에서 ‘베네팔리(BENEPALI®, 엔브렐 바이오시밀러)’,‘임랄디(IMRALDI®, 휴미라 바이오시밀러)’, ‘플릭사비(FLIXABI®, 레미케이드 바이오시밀러)’, ‘온트루잔트(ONTRUZANT®, 허셉틴 바이오시밀러)’를 판매하고 있으며, ‘에이빈시오’ 출시를 통해 유럽에서 총 다섯 종의 바이오의약품을 시장에 선보이게 됐다.

![긁어 부스럼 만든 발언?…‘티아라 왕따설’ 다시 뜨거워진 이유 [해시태그]](https://img.etoday.co.kr/crop/140/88/2100644.jpg)
![잠자던 내 카드 포인트, ‘어카운트인포’로 쉽게 조회하고 현금화까지 [경제한줌]](https://img.etoday.co.kr/crop/140/88/2100528.jpg)
![[단독]"한 번 뗄 때마다 수 백만원 수령 가능" 가짜 용종 보험사기 기승](https://img.etoday.co.kr/crop/140/88/2100020.jpg)
![8만 달러 터치한 비트코인, 연내 '10만 달러'도 넘보나 [Bit코인]](https://img.etoday.co.kr/crop/140/88/2100256.jpg)

![환자복도 없던 우즈베크에 ‘한국식 병원’ 우뚝…“사람 살리는 병원” [르포]](https://img.etoday.co.kr/crop/140/88/2099863.jpg)





!["한국은 '이것' 가능한 유일무이한 국가" 방산주 '이렇게' 투자할 때입니다 ㅣ 이영훈 이사 [찐코노미]](https://i.ytimg.com/vi/B9X9jpK5FGE/mqdefault.jpg)










![[찐코노미] "한국은 이것 가능한 유일무이한 국가"…방산주 '이렇게' 투자할 때](https://img.etoday.co.kr/crop/300/170/2100715.jpg)
![코스피 1% 이상 하락... 2531.66에 마감 [포토]](https://img.etoday.co.kr/crop/300/190/2100641.jpg)