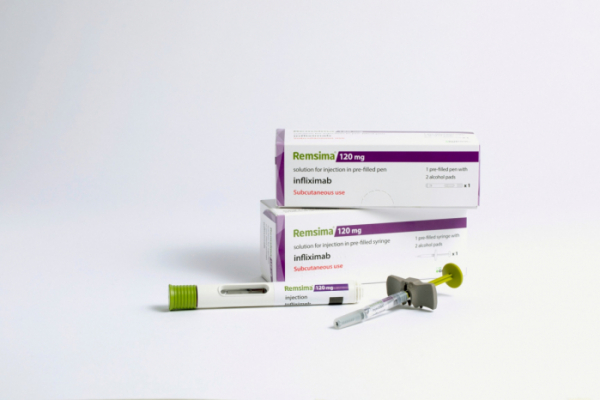
셀트리온의 인플릭시맙 피하주사 제제 '램시마SC'가 유럽 시장에 진출한다.
셀트리온은 유럽의약품청(EMA)으로부터 램시마SC의 판매 승인을 획득했다고 26일 밝혔다. 램시마SC는 램시마를 기존 정맥주사(IV)에서 피하주사(SC)로 제형을 변경해 셀트리온이 자체 개발한 바이오의약품이다.
EMA는 심사 과정부터 바이오베터 형식인 '확장 신청'이란 기존 바이오시밀러와 차별화된 승인 절차를 거쳤다. 셀트리온은 130여 개국에 램시마SC의 특허출원을 완료할 예정에 있어 향후 20년 간 인플릭시맙 피하주사 시장을 독점할 수 있다.
셀트리온 관계자는 "램시마SC는 바이오베터라는 독점적 지위를 이용, 가격 측면에서 1차 치료제(휴미라·엔브렐 등)보다 더 높은 가격에 판매할 수 있는 이른바 ‘프라임 시밀러’ 전략 구사가 가능해져 수익성 향상에 큰 기여를 할 것으로 기대한다"며 "전 세계 50조 원 규모의 TNF-α 억제제 시장에서 약 10조원 규모의 시장을 창출할 수 있을 것"이라고 내다봤다.
프라임 시밀러 전략은 1차 치료제에 내성이 생긴 환자들이 고가의 2차 치료제로 전환하기 전에 검증된 약효와 편리성, 그리고 약물경제성을 지닌 바이오베터 램시마SC를 사용하도록 하는 것이다. 셀트리온은 이번에 램시마SC가 승인받은 RA적응증에 추가해 내년 중반까지 염증성장질환(IBD)을 포함한 자가면역질환 적응증 전체에 대해 승인을 획득할 계획이다.
해외 유통 및 마케팅을 담당하는 셀트리온헬스케어는 14개의 법인 및 지점을 잇는 자체 직판망을 통해 램시마SC를 직접 판매한다. 내년 상반기까지 총 6조4000억 원 규모의 유럽 TNF-α 억제제 시장에 진출하고, 2020년 말까지 유럽 전체 TNF-α 억제제 시장의 90%에 해당하는 9조2000억 원 규모의 시장에 램시마SC를 선보일 방침이다. 2022년부터는 세계 최대 바이오의약품 시장인 미국에도 진출한다는 전략이다.
셀트리온 관계자는 "셀트리온은 이미 세계 유수의 학회를 통해 램시마SC 임상 결과를 발표하며 안전성과 효능을 입증했다"면서 "셀트리온헬스케어는 램시마SC의 시판을 계기로 유럽 시장에서 다른 바이오시밀러와 차별화된 프라임급 위치에서 시장점유율을 확대할 계획이며, 이를 바탕으로 램시마SC가 매출 증대와 수익성 개선에도 큰 몫을 할 것"이라고 말했다.

![어떤 주담대 상품 금리가 가장 낮을까? ‘금융상품 한눈에’로 손쉽게 확인하자 [경제한줌]](https://img.etoday.co.kr/crop/140/88/2101515.jpg)
![2025 수능 시험장 입실 전 체크리스트 [그래픽 스토리]](https://img.etoday.co.kr/crop/140/88/2101156.jpg)
!["최강야구 그 노래가 애니 OST?"…'어메이징 디지털 서커스'를 아시나요? [이슈크래커]](https://img.etoday.co.kr/crop/140/88/2101671.jpg)



















![[정치대학] 박성민 "尹대통령, 권위와 신뢰 잃었다"](https://img.etoday.co.kr/crop/300/170/2101600.jpg)
![예결위, 비경제부처 예산심사 첫날 [포토]](https://img.etoday.co.kr/crop/300/190/2101714.jpg)