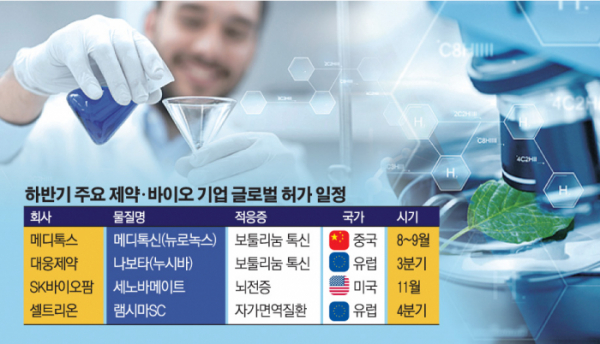
수면장애 신약 ‘솔리암페톨’의 미국 시판에 성공한 SK바이오팜은 뇌전증치료제 ‘세노바메이트’의 미국 식품의약국(FDA) 허가를 기다리고 있다. 세노바메이트는 국내 최초로 기술 수출하지 않고 독자적으로 후보물질 발굴부터 FDA 허가 신청까지 진행한 신약이라 더욱 의미가 크다. FDA는 올해 2월 세노바메이트의 신약판매 허가 신청서(NDA) 심사에 들어갔으며, 약 10개월의 검토 기간을 거쳐 11월 중 최종 허가를 획득할 것으로 예상된다.
SK바이오팜은 세노바메이트의 시판 허가 획득 후 미국 상업화 과정도 미국 법인 SK라이프사이언스를 통해 독자적으로 수행한다. 2020년 미국 판매를 시작으로 유럽을 거쳐 아시아 지역까지 세노바메이트의 상업화를 추진할 계획이다. 유럽에서는 6000억 원 규모의 기술 수출 계약을 맺은 스위스의 아벨 테라퓨틱스를 통해 유럽의약품청(EMA) 허가를 모색한다. EMA 허가를 받으면 세노바메이트는 영국·독일·프랑스·스위스 등 유럽 32개국에서 판매된다.
글로벌 뇌전증치료제 시장은 2021년 70억 달러(7조 8900억 원)에 달할 것으로 추정되는 대규모 시장이다. 업계는 세노바메이트가 미국에서 시판되면 2024년 매출 1조 원 달성이 가능할 것으로 전망한다.
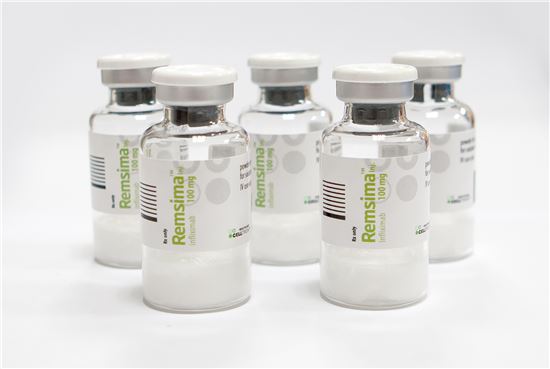
셀트리온은 비장의 카드 ‘램시마SC’의 연내 유럽 허가를 앞두고 있다. 램시마SC는 자가면역치료용 항체 바이오시밀러 ‘램시마’를 피하주사(SC) 제형으로 바꾼 약이다. 램시마의 오리지널 의약품인 ‘레미케이드’도 피하주사형으로 개발되지 않았기 때문에 램시마SC는 최초의 바이오베터가 된다. 셀트리온은 크론병 환자 대상 54주 임상 및 류머티스 관절염 임상에서 램시마SC의 정맥주사 대비 비열등성과 안전성을 확인, 허가에 차질이 없을 것으로 예상한다.
램시마SC는 레미케이드를 포함해 블록버스터 피하주사형 종양괴사인자(TNF-α) 억제제 ‘휴미라’와 ‘엔브렐’ 시장까지 침투할 수 있을 것으로 기대된다. 서정진 셀트리온그룹 회장은 “램시마SC는 연간 40조 원에 달하는 글로벌 자가면역질환 치료제 시장의 패러다임을 바꿀 바이오의약품”이라고 자신감을 드러낸 바 있다.
보툴리눔 톡신 균주 출처를 놓고 수년째 진실 공방을 벌이고 있는 메디톡스와 대웅제약도 각자 글로벌 시장의 문을 두드린다.
메디톡스의 국산 1호 보툴리눔 톡신 ‘메디톡신’(수출명 뉴로녹스)은 중국 시장에 정식 진출한다. 예정대로면 8월~9월 초 최종 시판허가를 획득할 수 있을 것으로 보인다.
한때 중국 허가 심사 중단설이 떠돌았으나, 중국약품감독관리(NMPA) 공식 사이트에 따르면 최근 뉴로녹스는 심사 상태가 ‘일시정지’에서 ‘심사 대기 중’ 상태로 변경됐다. 최종 시판허가 관련 작업을 진행한다는 의미다. 메디톡스 관계자는 “중국 허가 과정은 예정대로 순조롭게 진행되고 있다”며 “3분기 내 허가 획득이 가능하다”고 말했다.
중국에서 정식 판매가 가능해지면 메디톡스는 보따리상(따이공) 규제와 상관없이 안정적인 성장세를 유지할 수 있다. 중국 보툴리눔 톡신 시장은 약 5000억 원 규모로 추산되며, 불법 유통 시장(블랙마켓)까지 포함해 가파르게 성장 중이다.
대웅제약은 ‘나보타’(유럽명 누시바)의 유럽 허가가 임박했다. 유럽은 미국에 이어 3조5000억 원 규모의 세계 2위 보툴리눔 톡신 시장이다.
회사는 올해 4월 EMA 산하 약물사용자문위원회(CHMP)로부터 나보타의 미간 주름 적응증에 대해 허가승인 권고 의견을 받았다. CHMP는 의약품에 대한 유효성, 안전성 등 과학적 평가 결과를 바탕으로 허가 여부를 논의해 유럽연합(EU) 집행위원회에 의견을 제시하는 기구다. 통상 허가권고 이후 90일 이내 최종허가 여부를 결정하기 때문에 7월 중 허가 예정이었지만, 보완자료 제출을 요구하면서 다소 지연되고 있다. 집행위원회가 최종 허가 결정을 내리면 나보타를 EU 28개 국가와 노르웨이, 아이슬란드, 리히텐슈타인이 속한 유럽경제지역(EEA) 3개국 등 총 31개국에서 판매할 수 있다.

![다 상술인건 알지만…"OO데이 그냥 넘어가긴 아쉬워" [데이터클립]](https://img.etoday.co.kr/crop/140/88/2102336.jpg)
![‘2025 수능 수험표’ 들고 어디 갈까?…수험생 할인 총정리 [그래픽 스토리]](https://img.etoday.co.kr/crop/140/88/2102319.jpg)


















![‘남미 최초 100점 와이너리’ 까테나 자파타, 오감만족 풍미란 이런 것 [맛보니]](https://img.etoday.co.kr/crop/85/60/2102452.jpg)

![[정치대학] 이재명 '운명의 날'…시나리오별 정치권 파장](https://img.etoday.co.kr/crop/300/170/2102661.jpg)
!['수능 끝, 홀가분해요' [포토]](https://img.etoday.co.kr/crop/300/190/2102419.jpg)