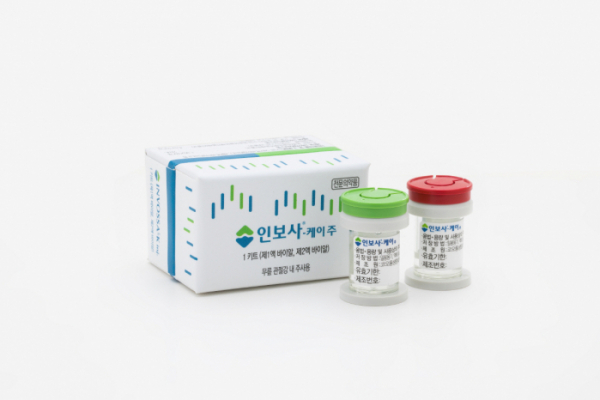
특히 코오롱티슈진이 세계 최초 골관절염 유전자 치료제인 ‘인보사 케이주(인보사)’세포 성분이 바뀐 사실을 2017년 3월 이미 알고 있었음이 드러나면서 현지 실사에 대한 관심이 집중되고 있다.
6일 코오롱생명과학 관계자는 “14일까지 관련 자료를 제출하고 식약처의 검토 시간을 고려하면 20일 즈음이 가장 유력할 것으로 예상한다”고 말했다.
식약처는 "그때 쯤으로 협의 중이나 아직 회사로부터 확답을 받지 못해 확정되지 않았다"고 밝혔다.
식약처의 현지 실사는 인보사 개발과정, 세포은행 등 전반적인 상황을 점검해 개발 초기부터 상업화에 이르기까지 동일한 신장세포가 사용됐다는 회사 측 주장이 사실인지 확인하는 데 초점이 맞춰질 것으로 보인다.
구체적으로는 코오롱티슈진의 마스터 셀 뱅크(MCB)를 확인하고 STR 검사로 2액의 293유래세포가 최초 세포에서 유래했는지, 최초 세포에서 293유래세포의 유전학적 특성이 나타나는지도 검사해 개발 초기부터 293유래세포가 사용된 것이 맞는지도 함께 확인할 예정이다.
인보사는 사람 연골세포(HC)가 담긴 1액과 연골세포 성장인자(TGF-β1)를 도입한 형질전환세포(TC)가 담긴 2액으로 구성된 골관절염 유전자치료제 주사액이다.
이는 코오롱티슈진이 개발했고, 2017년 코오롱생명과학이 식약처로부터 국내 첫 유전자치료제로 허가받았다.
앞서 최근 2액의 형질전환세포가 허가 당시 제출한 자료에 기재된 연골세포가 아닌 293유래세포로 드러난 가운데 코오롱생명과학은 전체 과정에서 동일한 세포를 사용해 안전성과 유효성에는 문제가 없다는 입장을 고수하고 있다.
식약처는 코오롱생명과학이 제출한 자료와 식약처 자체 시험결과, 미국 현지 실사 결과를 종합적으로 판단해 사실관계를 파악한 뒤 행정처분을 결정하기로 했다.

![어떤 주담대 상품 금리가 가장 낮을까? ‘금융상품 한눈에’로 손쉽게 확인하자 [경제한줌]](https://img.etoday.co.kr/crop/140/88/2101515.jpg)
![2025 수능 시험장 입실 전 체크리스트 [그래픽 스토리]](https://img.etoday.co.kr/crop/140/88/2101156.jpg)
!["최강야구 그 노래가 애니 OST?"…'어메이징 디지털 서커스'를 아시나요? [이슈크래커]](https://img.etoday.co.kr/crop/140/88/2101671.jpg)


















![[찐코노미] 美 취약점을 파고든 K방산의 미래…차기 방산 대장주는 '이것'?](https://img.etoday.co.kr/crop/300/170/2101653.jpg)
![예결위, 비경제부처 예산심사 첫날 [포토]](https://img.etoday.co.kr/crop/300/190/2101714.jpg)