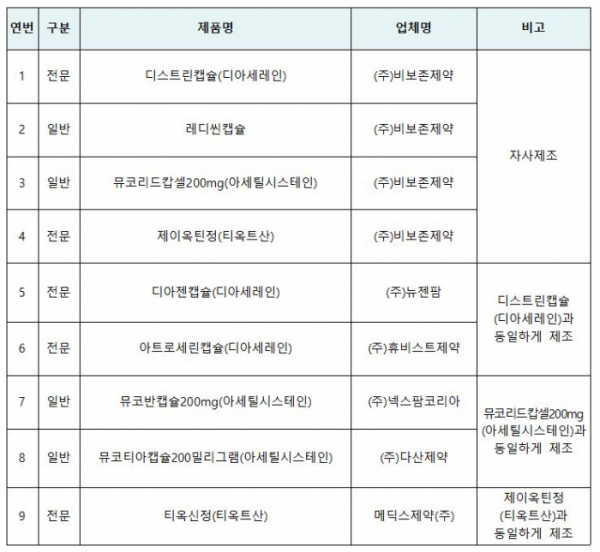
바이넥스에 이어 비보존제약의 9개 의약품이 허가 또는 신고된 사항과 다르게 제조돼 판매중지ㆍ회수 조치됐다.
식품의약품안전처는 정기점검을 통해 비보존제약이 자사에서 제조한 판매용 4개 의약품과 타사에서 위탁받아 수탁 제조한 5개 의약품이 허가사항과 다르게 제조한 것을 확인해 예방적 차원에서 해당 품목을 잠정 제조ㆍ판매중지 및 회수 조치한다고 12일 밝혔다.
비보존제약 측 관계자는 “지난해 이니스트제약을 인수했을 때 관련 내용을 안내받지 못했는데 회사 운영 방식을 확인하는 과정에서 허가변경을 받지 않고 의약품을 제조하고 있다는 사실을 먼저 파악하고 자진신고한 사안”이라고 말했다.
식약처는 이를 계기로 전국의 위‧수탁 제조소 30개소에 대해 긴급 특별 점검을 실시한다. 아울러 점검 결과 등을 고려해 향후 의약품 제조소 전체에 대한 점검으로 확대하는 등 재발 방지를 위한 종합적 제도개선 방안도 신속하게 마련해 추진한다는 입장이다.
식약처는 이번 비보존제약의 의약품이 회수 조치되면서 의‧약사 등 전문가에게 해당 제품을 다른 대체 의약품으로 전환하고 제품 회수가 적절히 수행될 수 있도록 협조 요청하는 안전성 속보를 의‧약사 및 소비자 등에게 배포했다. 또 보건복지부 및 건강보험심사평가원을 통해 병·의원 등에 해당 제품에 대한 처방 제한을 요청했다.
앞서 바이넥스 역시 자사의 6개 의약품과 다른 제약업체의 32개 품목을 허가 또는 신고된 사항과 다르게 제조한 것이 확인돼 식약처가 해당 의약품을 잠정 제조ㆍ판매 중지 및 회수조치했다. 식약처는 관련 조사가 마무리되면 변경허가를 받지 않고 제조한 내용 등과 관련해 추가적인 행정처분을 내릴 예정이다.

!['20년 째 공회전' 허울 뿐인 아시아 금융허브의 꿈 [외국 금융사 脫코리아]](https://img.etoday.co.kr/crop/140/88/2100022.jpg)
![[단독]"한 번 뗄 때마다 수 백만원 수령 가능" 가짜 용종 보험사기 기승](https://img.etoday.co.kr/crop/140/88/2100020.jpg)
![8만 달러 터치한 비트코인, 연내 '10만 달러'도 넘보나 [Bit코인]](https://img.etoday.co.kr/crop/140/88/2100256.jpg)

![환자복도 없던 우즈베크에 ‘한국식 병원’ 우뚝…“사람 살리는 병원” [르포]](https://img.etoday.co.kr/crop/140/88/2099863.jpg)






![불 꺼진 복도 따라 ‘16인실’ 입원병동…우즈베크 부하라 시립병원 [가보니]](https://img.etoday.co.kr/crop/85/60/2099872.jpg)
![[BioS]한미약품, 11일 기관투자자 대상 기업설명회 열어](https://img.etoday.co.kr/crop/85/60/2100453.jpg)






![“과립·멸균 생산, 독보적 노하우”...‘단백질 1등’ 만든 일동후디스 춘천공장 [르포]](https://img.etoday.co.kr/crop/85/60/2099348.jpg)
![[정치대학]이재명, 정치운명 가를 ‘운명의 주’…시나리오별 파장은?](https://img.etoday.co.kr/crop/300/170/2100294.jpg)
![한경협 ‘미국 신정부 출범, 한국 경제 준비되었는가’ 좌담회 [포토]](https://img.etoday.co.kr/crop/300/190/2100445.jpg)