7년 전 시장에서 사라진 ‘시부트라민’ 성분의 비만치료제가 무더기로 허가를 자진 반납했다. 오리지널 의약품 ‘리덕틸’의 허가가 취하된 이후에도 5년 동안 허가를 유지하다 지난달부터 본격 시행된 의약품 품목 갱신제로 인해 제약사들이 자진 품목 정리에 나선 결과다. 판매하지 않거나 매출 규모가 미미한 제품들의 집단 철수가 예상된다.
4일 식품의약품안전처에 따르면 종근당의 ‘실크라민’, 한미약품의 ‘슬리머’, 구주제약의 ‘씨라민’, 대웅제약의 ‘엔비유’, 서울제약의 ‘서울말레인산시부트라민’ 등 ‘시부트라민’ 성분의 비만치료제 5개 품목의 허가가 취하됐다. 제약사들이 시장에서 팔지 않겠다고 품목 허가를 자진 반납했다는 의미다.
‘리덕틸’이 오리지널 의약품인 시부트라민은 지난 2008년 국내제약사들이 집중적으로 두드렸던 제네릭 시장이다. 시부트라민은 한때 ‘가장 안전한 비만약’이라는 호평을 받으며 비만치료제 중 가장 많이 팔렸다. 국내사 30여곳이 시부트라민 성분의 제네릭 시장에 뛰어들었다.
시부트라민은 2010년 부작용 위험성으로 인해 이미 시장에서 퇴출된 약물이다.
지난 2010년 1월 유럽의약품청(EMEA)는 애보트가 진행한 한 연구를 토대로 시부트라민 성분 비만약이 '유익성보다 위해성이 크다'는 이유로 판매중단을 결정했다. 2003년부터 9880명을 대상으로 진행한 리덕틸을 복용한 환자중 11.4%에서 심장발작 등 심장관련 위험성이 나타났다는 이유에서다.
2010년 10월 미국 FDA가 "시부트라민의 유익성이 위험성을 앞선다고 판단되지 않는다"며 판매중단을 결정했고 국내에서도 시부트라민 성분 의약품은 시장에서 쫓겨났다.
이후 2012년 1월 한국애보트는 리덕틸의 품목허가를 자진 취하했다. 만약 '위험성이 크지 않다'는 점을 입증할 새로운 연구가 발표된다면 기적적으로 회생할 수 있지만 자발적으로 시장 포기를 선언했다.
리덕틸의 허가 취하 이후에도 국내제약사들은 ‘시부트라민’의 허가를 취하하지 않고 유지하고 있었다. 시장에서 판매하지 않더라도 향후 만약 팔 수 있는 기회가 발생할지도 모른다는 속내가 있었던 것으로 분석된다. 사실 국내제약사들은 허가받은 이후 판매하지 않더라도 허가 유지하는데 별도의 비용이 소요되지 않기 때문에 좀처럼 허가를 취하하지 않는 관행이 깊숙이 자리잡고 있다.
시부트라민 성분 비만약의 무더기 취하는 지난달부터 본격 시행된 의약품 품목 갱신제와 연관이 깊다.
지난 2012년 약사법 개정을 통해 근거가 마련된 의약품 품목 갱신제는 보건당국으로부터 허가받은 의약품은 5년 마다 효능·안전성을 재입증해야 허가가 유지되는 내용이 핵심이다.
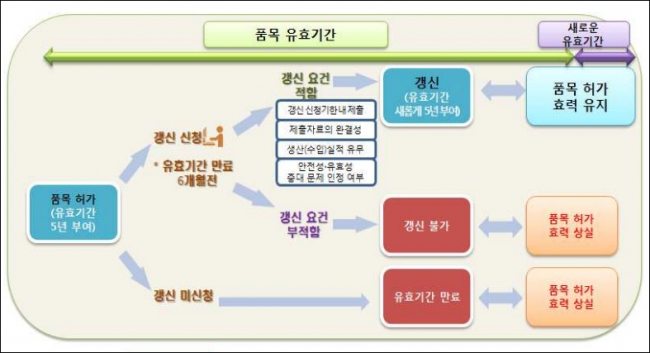
기존에 시판중인 의약품은 재평가라는 절차를 통해 16~20년에 한번 정도 안전성과 유효성을 검증받았다. 하지만 급속한 과학 발전에 따른 합리적인 평가체계 운영이 필요하다고 판단, 갱신제를 도입했다.
2013년 1월1일부터 허가받은 의약품은 5년 마다 안전성·효능 관련 자료를 제출하고 식약처로부터 적합 판정을 받아야만 판매가 유지된다. 2013년 이전에 허가받은 의약품은 식약처가 별도로 지정한 분류번호에 따라 2018년 9월30일부터 품목 갱신 관련 자료를 제출해야 한다.
5년의 유효기간 동안 수집된 안전관리에 관한 자료 및 조치계획, 외국에서의 사용현황 및 안전성 관련 조치에 관한 자료, 유효기간 동안 수집된 품질관리에 관한 자료, 제조·수입 실적에 관한 자료 등이 자료 제출 대상이다.
제약사들은 품목 갱신 자료를 유효기간 6개월 전에 제출해야 한다. 2013년 1월 1일 허가받은 의약품은 2018년 1월 1일까지 허가가 유효하지만, 품목을 갱신받으려면 유효기간 6개월 전인 2017년 7월1일까지 자료를 제출해야 한다는 얘기다. 지난달부터 제약사들이 품목 갱신자료를 제출을 시작하며 본격적으로 품목 갱신제가 시행됐다.
품목 갱신제 시행으로 제약사들은 판매하지 않는 의약품의 허가를 유지할 이유가 사라졌다. 시부트라민과 같이 오리지널 의약품의 허가가 없는 제네릭의 경우 품목을 갱신할 자료가 전무하다. 허가를 유지할 근거가 없다는 얘기다. 더욱이 품목 갱신을 위해서는 별도의 수수료도 부담해야 한다. 식약처는 의약품 품목갱신 신청 수수료를 36만3000원(전자민원)·40만4000원(방문·우편민원)으로 책정했다.
제약사들은 서둘러서 품목 정리 작업에 돌입해야 하는 상황이다. 품목 갱신 대상인데도 자료를 제출하지 않으면 판매금지 행정처분을 받게 된다.
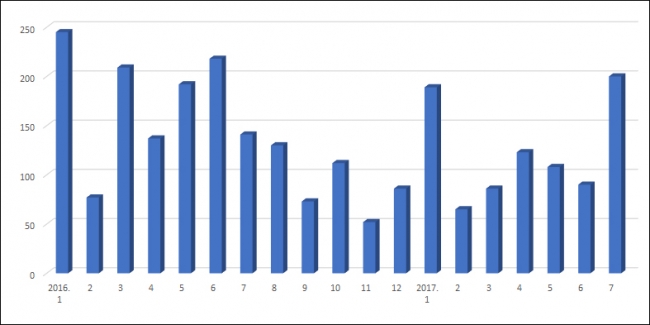
실제로 제약사들의 허가 취하 건수가 급증하는 추세다. 지난달 품목 허가가 취하된 의약품은 총 200건으로 올해 들어 가장 많았다. 지난주(7월24일~7월30일) 한 주 동안에만 무려 165개 품목의 허가가 취하됐다. 한독은 지난주에만 29개 품목의 허가를 반납했다. ‘멜콕스’, ‘베디롤’, ‘리피다틴’ 등 대부분 처방실적이 미미한 제품이다.
일동제약은 지난 6월 31개 품목의 허가를 취하했다. ‘아로나민정’, ‘아로나민실버’ 등 후속 모델로 리뉴얼된 제품들이 대거 취하됐고 가루형태의 비아그라 제네릭 ‘스피덴세립’과 같이 이미 기존에 판매를 중단한 제품들도 취하 목록에 포함됐다.
업계 한 관계자는 “의약품 품목 갱신제의 시행으로 제약사마다 대대적으로 품목 정리 작업에 착수했다. 판매하지 않거나 시장성이 불투명한 제품들은 불필요한 품목 유지 비용만 투입되기 때문에 향후 제약사들의 보유 품목 수는 현저히 줄어들 전망이다”라고 말했다.

![어떤 주담대 상품 금리가 가장 낮을까? ‘금융상품 한눈에’로 손쉽게 확인하자 [경제한줌]](https://img.etoday.co.kr/crop/140/88/2101515.jpg)
![2025 수능 시험장 입실 전 체크리스트 [그래픽 스토리]](https://img.etoday.co.kr/crop/140/88/2101156.jpg)
!["최강야구 그 노래가 애니 OST?"…'어메이징 디지털 서커스'를 아시나요? [이슈크래커]](https://img.etoday.co.kr/crop/140/88/2101671.jpg)


















![[찐코노미] 美 취약점을 파고든 K방산의 미래…차기 방산 대장주는 '이것'?](https://img.etoday.co.kr/crop/300/170/2101653.jpg)
![예결위, 비경제부처 예산심사 첫날 [포토]](https://img.etoday.co.kr/crop/300/190/2101714.jpg)