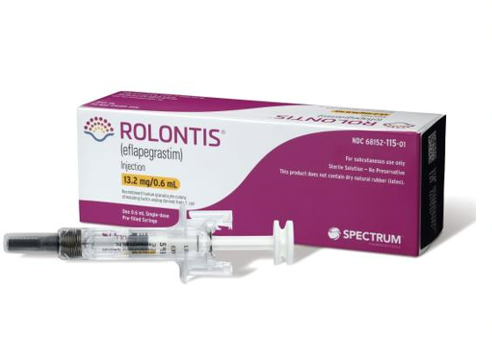
한미약품이 개발한 호중구감소증 치료 바이오신약 ‘롤론티스’가 미국 식품의약국(FDA) 시판허가 승인을 획득했다.
한미약품 파트너사 스펙트럼은 FDA로부터 롤론티스(미국 제품명 롤베돈)의 시판허가를 승인하는 통지문을 받았다고 10일(미국시간 9일) 밝혔다.
이번 FDA의 시판허가는 한미약품이 개발한 신약 중 처음이다. FDA 실사를 통과한 국내 공장(한미약품 평택 바이오플랜트)에서 생산해 FDA 허가를 받아 미국 시장으로 진출하는 국내 첫 번째 바이오신약이기도 하다. 한국 제약업계 전체로는 여섯 번째 FDA 신약 시판허가 사례다.

한미약품과 스펙트럼은 롤론티스의 성공적 미국 시장 출시를 위한 준비를 시작했다. 미국 전역으로 확대한 영업 네트워크를 토대로 연내 최대한 신속히 미국 시장에 제품을 출시할 계획이다.
호중구감소증은 고형암이나 악성 림프종 환자가 세포독성화학요법을 투여한 후 혈액 내 호중구가 감소해 생기는 질병으로 미국 시장 규모만 3조 원대로 추산된다. 롤론티스가 시판되면 한미약품은 스펙트럼으로부터 판매에 따른 로열티를 받는다.
권세창 한미약품 대표이사 사장은 “한미약품 신약 중 첫 FDA 허가 사례일 뿐 아니라, 한미의 독자적 플랫폼 기술인 ‘랩스커버리’의 상용화 가능성을 입증했다는 데 큰 의미가 있다”며 “롤론티스의 상업적 성공 및 랩스커버리 기반 바이오신약들의 미래가치 동반상승의 결정적 계기가 될 것으로 기대한다”고 말했다.

!['20년 째 공회전' 허울 뿐인 아시아 금융허브의 꿈 [외국 금융사 脫코리아]](https://img.etoday.co.kr/crop/140/88/2100022.jpg)
![[단독]"한 번 뗄 때마다 수 백만원 수령 가능" 가짜 용종 보험사기 기승](https://img.etoday.co.kr/crop/140/88/2100020.jpg)
![8만 달러 터치한 비트코인, 연내 '10만 달러'도 넘보나 [Bit코인]](https://img.etoday.co.kr/crop/140/88/2100256.jpg)

![환자복도 없던 우즈베크에 ‘한국식 병원’ 우뚝…“사람 살리는 병원” [르포]](https://img.etoday.co.kr/crop/140/88/2099863.jpg)












![불 꺼진 복도 따라 ‘16인실’ 입원병동…우즈베크 부하라 시립병원 [가보니]](https://img.etoday.co.kr/crop/85/60/2099872.jpg)
![[BioS]한미약품, 11일 기관투자자 대상 기업설명회 열어](https://img.etoday.co.kr/crop/85/60/2100453.jpg)


![[정치대학]이재명, 정치운명 가를 ‘운명의 주’…시나리오별 파장은?](https://img.etoday.co.kr/crop/300/170/2100294.jpg)
![하나금융그룹, '모두하나데이' 소외계층에 김장김치 1만1111포기 전달 [포토]](https://img.etoday.co.kr/crop/300/190/2100477.jpg)