
대웅제약이 SGLT-2 저해제 ‘이나보글리플로진’의 세번째 국내 임상 3상에 들어간다.
대웅제약은 4일 당뇨병 치료제 후보물질 ‘이나보글리플로진’과 메트포르민(Metformin), DPP-4 저해제를 합한 삼중요법에 대해 식품의약품안전처로부터 임상 3상을 승인받았다고 밝혔다.
이로써 대웅제약은 이나보글리플로진의 단독 요법, ‘이나보글리플로진+메트포르민’ 병용요법에 이어 ‘이나보글리플로진+메트포르민+DPP4 저해제’ 삼중요법까지 3개의 임상 3상을 진행하게 된다.
발표에 따르면 대웅제약은 메트포르민과 DPP-4 저해제를 병용 투여해도 혈당 조절이 되지 않는 제 2형 당뇨병 환자 250명을 대상으로 메트포르민, DPP-4 저해제와 함께 이나보글리플로진를 투여해 안전성과 혈당강하효과를 평가한다. 임상연구는 가톨릭대 부천성모병원을 포함해 전국 20여개 대형병원에서 진행된다.
특히 대웅제약은 최근 ‘이나보글리플로진’이 국내 최초 신속심사대상(패스트트랙) 의약품으로 지정돼 신약허가 기간을 단축할 수 있게 됐으며, 오는 2023년 국내 발매를 목표로 하고 있다고 설명했다.
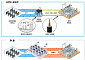
이나보글리플로진은 신장에서 포도당의 재흡수에 관여하는 SGLT-2수송체를 선택적으로 억제함으로써, 포도당을 직접 소변으로 배출시키는 기전이다.
전승호 대웅제약 사장은 “대웅제약은 경도부터 중등도까지의 제2형 당뇨병 환자의 혈당 조절을 위해 이나보글리플로진의 적응증 확대를 위해 노력하고 있다”며 “SGLT-2 저해제 약물이 심부전 및 만성신부전 치료제 등으로 영역이 확장되고 있는 만큼 이나보글리플로진도 당뇨병 외 다양한 질병으로 적응증을 확대해 나갈 예정이다”라고 말했다.
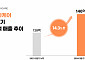
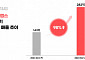
한편, 대웅제약은 지난 9월 국제학술대회 2020 ICDM에서 긍정적인 임상 2상의 결과를 공개한 바 있다. 구체적으로 제 2형 당뇨병 환자를 대상으로 이나보글리플로진을 12주 투여 후 위약과 단독 비교 한 결과, 혈당 조절의 주요지표인 당화혈색소(HbA1c) 변화량이 위약 대비 약 0.9%감소한 것으로 나타났다. 또 당뇨병 임상지표인 ‘당화혈색소 7.0% 이하로 도달한 환자 비율’이 최대 61%, 치료 전 대비 당화혈색소가 0.5% 감소한 환자비율은 최대 72%를 보였다.

![다 상술인건 알지만…"OO데이 그냥 넘어가긴 아쉬워" [데이터클립]](https://img.etoday.co.kr/crop/140/88/2102336.jpg)
![‘2025 수능 수험표’ 들고 어디 갈까?…수험생 할인 총정리 [그래픽 스토리]](https://img.etoday.co.kr/crop/140/88/2102319.jpg)

















![다 상술인건 알지만…"OO데이 그냥 넘어가긴 아쉬워" [데이터클립]](https://img.etoday.co.kr/crop/300/170/2102336.jpg)
!['수능 끝, 홀가분해요' [포토]](https://img.etoday.co.kr/crop/300/190/2102419.jpg)