
제넥신은 25일 하이루킨-7 미국 뇌암 임상이 NCI의 암 치료 평가 프로그램(Cancer Therapy Evaluation Program, CTEP)에 채택돼 임상연구비를 지원받게 됐다고 밝혔다. 뇌암 환자 대상으로 하이루킨-7의 미국 임상 1b~2a상은 지난 3월 미국 FDA의 승인을 받았다.
이에 따라 하이루킨-7의 미국 내 첫 번째 임상은 NCI의 지원을 받아 존스홉킨스의 Stuart Grossman, MD 교수의 지휘 아래 성인 뇌암 컨소시엄(Adult Brain Tumor Consortium, ABTC)과 임상을 진행할 예정이다.
성인 뇌암 컨소시엄(ABTC)과 면역 항암 임상 네트워크(Cancer Immunotherapy Trials Network, CITN)가 공동으로 진행하는 이번 임상은 화학 방사선요법을 받은 뇌암 환자에서 하이루킨-7이 림프구 수치를 상승시키는 정도를 바이오마커 분석을 통해 확인할 예정이다. 또한 뇌암의 새로운 치료기전으로서 하이루킨-7의 투약용량 확인 및 효능과 부작용도 평가 예정이다. 이번 임상은 약 12~75명의 환자를 대상으로 진행된다.
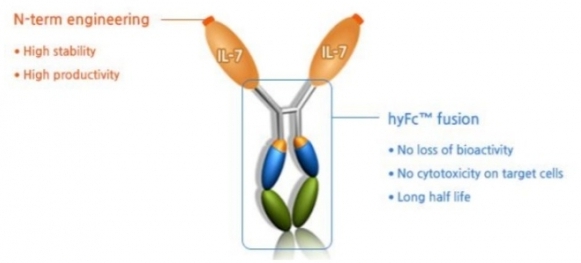
하이루킨은 인터루킨-7에 제넥신의 플랫폼 기술인 hyFc 기술을 적용해 제조한 융합단백질로서 인터루킨-7 단백질에 비해서 체내 반감기 및 효력이 크게 증가한 제품으로서 T 세포를 만들어 내고 암 조직으로 이동시키고 T 세포가 오래 살도록 해준다. 하이루킨은 최근 글로벌제약사인 로슈와 하이루킨-7과 PD-L1 타깃 면연관문억제제 테센트릭을 병용하는 임상을 추진키로 했다. 흑색종, 머켈세포암(Merkel cell carcinoma), 피부편평세포암(cutaneous squamous cell carcinoma) 3가지 적응증을 대상으로 한다.

!['20년 째 공회전' 허울 뿐인 아시아 금융허브의 꿈 [외국 금융사 脫코리아]](https://img.etoday.co.kr/crop/140/88/2100022.jpg)
![[단독]"한 번 뗄 때마다 수 백만원 수령 가능" 가짜 용종 보험사기 기승](https://img.etoday.co.kr/crop/140/88/2100020.jpg)
![8만 달러 터치한 비트코인, 연내 '10만 달러'도 넘보나 [Bit코인]](https://img.etoday.co.kr/crop/140/88/2100256.jpg)

![환자복도 없던 우즈베크에 ‘한국식 병원’ 우뚝…“사람 살리는 병원” [르포]](https://img.etoday.co.kr/crop/140/88/2099863.jpg)







![불 꺼진 복도 따라 ‘16인실’ 입원병동…우즈베크 부하라 시립병원 [가보니]](https://img.etoday.co.kr/crop/85/60/2099872.jpg)
![[BioS]한미약품, 11일 기관투자자 대상 기업설명회 열어](https://img.etoday.co.kr/crop/85/60/2100453.jpg)






![“과립·멸균 생산, 독보적 노하우”...‘단백질 1등’ 만든 일동후디스 춘천공장 [르포]](https://img.etoday.co.kr/crop/85/60/2099348.jpg)
![[정치대학]이재명, 정치운명 가를 ‘운명의 주’…시나리오별 파장은?](https://img.etoday.co.kr/crop/300/170/2100294.jpg)
![오세훈 서울시장, 제7회 AI·드론봇 전투발전 콘퍼런스 [포토]](https://img.etoday.co.kr/crop/300/190/2100458.jpg)