우리는 자식 세대에게 나와 닮은 눈, 코, 입 뿐 아니라 보이지 않는 질병의 위험인자까지 전해줄 수 있다. 부모의 유전자가 자손에게 전달되기 때문으로 세포 핵 속에 있는 염색체 구성 성분인 DNA가 그 역할을 한다. 세포 안에서 긴 사슬 형태의 두 가닥이 서로 결합해 꼬인 나선 형태로 존재하는 DNA에는 우리 몸을 구성하는 단백질을 만드는 정보가 들어 있다.
이 때문에 DNA는 유전 질환의 치료에 근원적으로 접근하는 방법으로 주목받았고 실제로도 많은 연구가 진행됐다. 하지만 진단 혹은 치료 목적으로 DNA에 특정 물질을 인위적으로 첨가하고자 시도할 때, 체내에 존재하는 분해효소들의 작용으로 결과물이 신통치 않았다. 새로운 대안에 대한 고민도 시작됐다.
펩타이드 결합의 인공 DNA
1991년 코펜하겐의 4명의 과학자 피터 넬슨(Peter E. Nielsen), 마이클 에그호름(Michael Egholm), 랄프 버그(Rolf H. Berg), 올레 부카르츠(Ole Buchardt)는 PNA(peptide nucleic acid)를 처음 발명한다. DNA의 생화학적 불안정성을 보완하기 위해 유기합성으로 만들어진 인공물질이다.
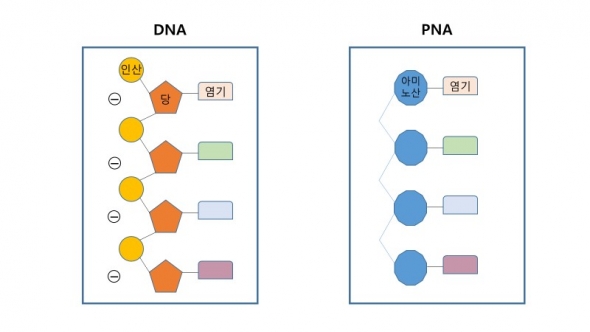
PNA는 DNA의 당-인산 뼈대를 펩타이드 결합체로 치환한 것으로 DNA 뼈대 구조가 가지는 음전하의 성격을 띠지 않는 중성적인 구조를 가진다. 이러한 특징으로 인해 PNA가 가지는 장점은 크게 세 가지다.
첫째, PNA는 전하를 띠지 않아 강한 결합력을 가진다. DNA는 전기적으로 음전하를 띠기 때문에 이중 나선구조를 이루기 위해서 DNA끼리 결합할 때, 같은 극끼리 밀어내는 힘이 존재하지만 PNA는 전하를 띠지 않는 중성의 뼈대를 가지므로 DNA나 RNA와 결합하는 과정에서 전기적 반발이 일어나지 않는다. 그래서 PNA-DNA 결합의 결합력이 자연적인 DNA 이중나선구조의 결합력보다 강하다.
두번째로 PNA는 높은 안정성을 가진다. 펩타이드 결합물로 뼈대를 치환한 PNA는 화학적으로 핵산이기 보다는 단백질(펩타이드)에 가깝기 때문에 체내의 핵산분해효소 등에 강한 저항성을 가지고 성능을 유지할 수 있다.
세번째로 인위적 합성으로 만들어진 PNA는 형광표지나 유용한 분자들을 손쉽게 활용할 수 있도록 2차 변형이 편리하다는 장점을 가진다. PNA의 화학구조에 특정 분자 또는 작용기를 연결해 물리화학적 성질을 용도에 맞게 변형하는 것이 가능하다.
진단 검출과 치료에서의 PNA의 활용
PNA는 합성 DNA와 비교해서 더 단단한 결합과 더 훌륭한 안정성을 강점으로 한다. 그래서 유전자 진단, 가시적 분자결합화(in situ hybridization)이나 PCR clamping, 플라스미드 벡터 표지법과 같은 다양한 분자생물학적 기술에도 적용이 가능하다. PNA는 텔로미어의 양적 분석, 유전체 염색, 바이러스와 박테리아 진단 등의 분야에서 이용되고 있다.
PNA의 장점이 가장 강력하게 드러나는 활용 실험은 유전자 내 돌연변이 검출을 위해 시행되는 PCR(polymerase chain reaction)이다. 분자진단에서 표적 핵산 염기서열을 검출하는 방법으로 PCR을 주로 사용하는데, 이는 쉽게 말해 표적 핵산을 대량 복제, 증폭함으로써 표적 존재 유무를 판단하는 것이다.
하지만 이러한 PCR 방법은 적은 수의 염기가 변이된 미세한 돌연변이를 제대로 검출하지 못하거나, 정상형과 변이형이 섞인 상황에서 선택적 증폭 능력이 낮아 검사의 민감도가 떨어진다.
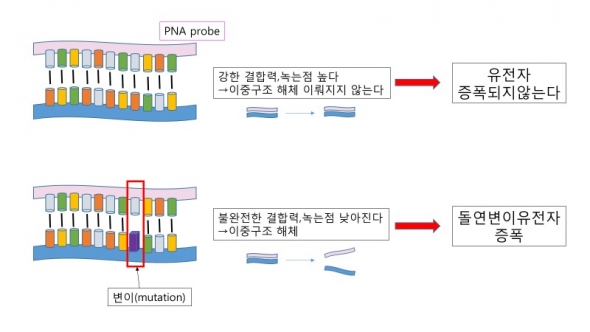
표적 염기서열과 PNA가 단단하게 결합해 이중 구조를 이룰 때, PNA-DNA의 이중구조는 증폭되기 위해서 다시 단일 구조로 풀어지는 녹는점 온도가 높다. 그런데 돌연변이가 생겨서 염기서열의 오차가 발생하면 결합력이 약해지고 녹는점 온도가 떨어진다. 이 온도의 차이는 DNA를 사용한 경우의 온도차보다 더 크다.
이러한 PNA의 장점을 이용해 기존의 PCR 기법의 한계를 극복하기 위해 나온 것이 PNA 클램프(clamp) 기술이다.
정상적인 유전자 염기서열에 결합을 하는 PNA 클램핑 염기서열을 디자인하면 강력한 이중구조를 형성한다. 연쇄 중합반응이 일어날 때,상보적 염기서열의 오차로 인해 녹는점이 낮아진 돌연변이형 유전자만이 단일구조화 돼 계속적으로 증폭이 일어난다. 이러한 과정을 통해 정상유전자의 1만 분의 1 정도(PANA Mutyper 기술)로 적은 양이 존재하는 돌연변이 염기서열도 검출이 가능하다.
타깃을 식별하는 능력이 탁월하고 세포 안까지 안정적으로 전달이 가능한 것이 필수조건인 유전자 치료제 개발에서도 높은 생화학적 안정성을 가진 PNA는 매력적인 물질이다.
진핵세포 핵 안의 유전자로부터 물질 합성을 위한 mRNA(messenger RNA)가 생성되고, 세포질로 빠져나온 mRNA의 염기서열을 분석해서 아미노산을 배열, 결합하는 과정을 통해 물질이 합성된다. 이 과정에서 PNA를 활용하는 방법은 mRNA의 합성을 억제하는 안티-진(anti-gene)으로서의 전략과 mRNA가 해석돼 단백질을 합성하는 과정을 방해하는 안티-센스(anti-sense)로서의 전략, 두 가지가 있다.
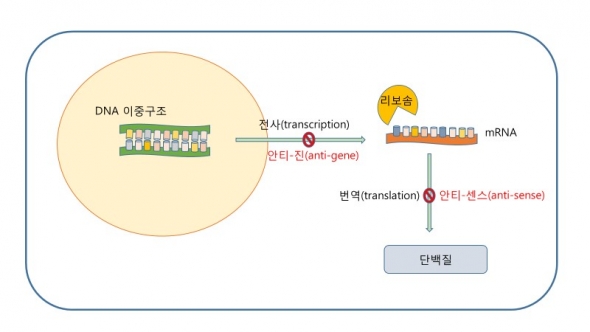
안티-진 전략에서는 디자인한 PNA가 DNA의 염기서열에 결합해서 삼중 구조, 혹은 스트랜드(strand)이동 복합체를 형성해 전사과정(transcription)에서의 RNA 중합효소의 기능을 차단한다. 이 방법은 mRNA가 만들어지는 것을 차단해 물질 생성을 억제한다.
안티-센스 전략을 사용할 때는 이미 만들어져 핵을 빠져나온 mRNA에 결합하는 PNA를 디자인한다. 이 때 PNA는 리보솜이 mRNA의 염기서열을 분석, 번역하는 것을 방해함으로 단백질합성을 억제한다.
DNA, RNA와 비교했을 때 PNA는 분해효소에 큰 저항력을 가지고 높은 안정성을 가진 장점이 존재하지만, 중성의 뼈대를 가져 전하를 띠지 않는 탓에 세포막을 통과하는 것이 어렵다는 단점도 존재한다. 유전자 치료제로서 활용하기 위해서는 반드시 세포 내로 진입해야 하기 때문에 PNA를 치료제로 개발하는 데 어려움이 있었다.
그러나 기술이 발달하면서 세포 내로의 PNA 전달 능력을 높여주는 방법들이 연구되고 있다. PNA의 구조에 결합인자를 달아 세포막에의 접착을 강화 시켜주는 방법과 짧은 펩타이드를 연결함으로 세포 내 전달 능력을 더 효율적으로 만드는 방법 등이 소개됐다.
파나진 시선바이오 올리패스 등 PNA 연구
이처럼 PNA는 유전자 질병 진단과 치료 측면에서 아주 효율적인 물질이기 때문에 연구자들이 17년간 많은 실험을 진행했고 결과를 발표했다. 하지만 고품질 PNA의 제한된 생산량으로 인해 대규모 임상이나 실험을 진행하는 데 어려움이 있었다. 파나진(Panagene)의 김성기 대표는 고순도의 PNA 대량 제조 기술을 개발했고 원 발명자들에게 기술을 인정받아 2006년부터 세계 독점 판매권을 소유하고 있다.
파나진은 고농도의 PNA를 주문 제작의 형태로 연구용으로 생산 판매하면서 동시에 PNA를 이용한 다양한 실험 기법을 통해 진단 키트를 개발, 판매하고 있다.
시선바이오머티리얼스는 PNA의 성질을 이용해 개발한 자체 진단기술 MeltingArray와 차세대염기서열분석기법을 사용한 동반진단 개발을 진행하고 있다. 또한 안티-센스 전략으로 PNA를 이용해 대상 유전자의 발현을 억제하는 유전자 치료제 개발도 추진하고 있다.
올리패스는 PNA 구조에 양전하를 띤 지질 입자를 부착해 세포막 통과 효율을 100만배 이상 증가시키는 기술을 가지고 있다. 이를 이용해 핵 속에서 mRNA가 합성되는 과정을 통제, 제한함으로써 질병을 유발하는 물질의 합성을 막는다. 신경병증 통증과 같은 ‘First in class’ 약물부터 비만과 같은 삶의 질을 저해하는 질환까지 다양한 적응증을 대상으로 치료제 개발을 진행하고 있다.

![어떤 주담대 상품 금리가 가장 낮을까? ‘금융상품 한눈에’로 손쉽게 확인하자 [경제한줌]](https://img.etoday.co.kr/crop/140/88/2101515.jpg)
![2025 수능 시험장 입실 전 체크리스트 [그래픽 스토리]](https://img.etoday.co.kr/crop/140/88/2101156.jpg)
!["최강야구 그 노래가 애니 OST?"…'어메이징 디지털 서커스'를 아시나요? [이슈크래커]](https://img.etoday.co.kr/crop/140/88/2101671.jpg)


















![[찐코노미] 美 취약점을 파고든 K방산의 미래…차기 방산 대장주는 '이것'?](https://img.etoday.co.kr/crop/300/170/2101653.jpg)
![예결위, 비경제부처 예산심사 첫날 [포토]](https://img.etoday.co.kr/crop/300/190/2101714.jpg)