식품의약품안전처는 한·미 자유무역협정(FTA)에 따른 의약품허가특허연계제도가 오는 15일부터 시행된다고 13일 밝혔다.
식약처는 이번 제도의 원활한 시행을 위해 관련 약사법·약사법 시행령·의약품 등의 안전에 관한 규칙을 이날 공포한다.
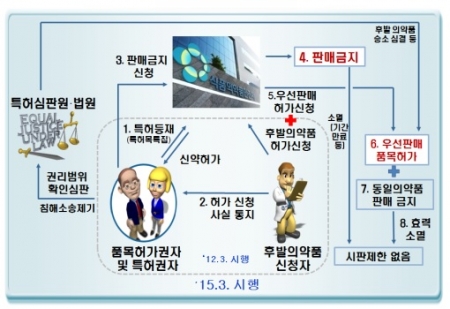
이번 법령의 주요 내용은 △의약품에 관한 특허권의 등재 및 특허권자에게 통지 제도의 개선 △특허 분쟁에 따른 판매금지조치의 마련 △우선판매품목허가제도의 신설 등이다.
법령에 따르면 의약품 품목허가를 받은 자가 의약품특허권을 등재하려는 경우 특허권자의 동의를 받도록 하는 내용이 신설됐고, 허가일 전에 출원된 특허만을 등재할 수 있도록 됐다. 또 후발 의약품의 (허가)신청자가 특허권자에게 통지해야 하는 기간이 기존의 7일에서 20일로 늘어났다.
특허권자가 후발 의약품 (허가)신청자에게 특허 침해예방 청구 소송 등을 제기하고 식약처에 판매금지 신청을 하면, 9개월간 후발 의약품의 판매가 금지된다. 다만 특허심판원·법원이 후발 의약품 (허가)신청자가 특허권자의 등재된 특허를 침해하지 않았다는 것을 인정하면, 후발 의약품 (허가)신청자는 ‘우선판매품목허가’를 통해 9개월간 해당 의약품을 우선 판매할 수 있다.
식약처는 이번 제도의 원활한 정착과 제약업계의 이해를 돕기 위해 △제도 개요 △기존 제도와 달라지는 사항 △새롭게 도입되는 제도 변화 △허가(신고)절차에서 달라지는 사항 등을 담은 ‘의약품 허가특허연계제도 안내서’도 홈페이지에 게재한다. 특히 제약업계가 관심이 많은 제도 적용 시점·통지의무가 발생하는 변경허가 신청범위 등에 대해 상세히 안내한다.
식약처 측은 “제도 시행일인 3월15일 이후 특허목록에 등재된 의약품의 자료를 이용한 허가 신청자부터 신설된 판매금지 및 우선판매품목허가제도의 적용을 받는다”며 “품목허가를 받은 자가 효능·효과 외의 사유로 의약품 허가사항을 변경하려는 경우에는 특허권자에게 통지하지 않아도 된다”고 설명했다.
이어 “이번 제도 시행과 더불어 의약품특허권 보호와 함께 국내 후발 의약품의 균형적인 발전을 위해 노력하겠다”면서 “제도의 원활한 정착을 위해 설명회 등을 지속적으로 개최하겠다”고 덧붙였다.
한편 이와 관련한 자세한 내용은 홈페이지(www.mfds.go.kr) → 법령자료 → 자료실 → 매뉴얼/지침에서 확인할 수 있다.

![다 상술인건 알지만…"OO데이 그냥 넘어가긴 아쉬워" [데이터클립]](https://img.etoday.co.kr/crop/140/88/2102336.jpg)
![‘2025 수능 수험표’ 들고 어디 갈까?…수험생 할인 총정리 [그래픽 스토리]](https://img.etoday.co.kr/crop/140/88/2102319.jpg)




















![[정치대학] 이재명 '운명의 날'…시나리오별 정치권 파장](https://img.etoday.co.kr/crop/300/170/2102661.jpg)
!['수능 끝, 홀가분해요' [포토]](https://img.etoday.co.kr/crop/300/190/2102419.jpg)