셀트리온이 개발 중인 코로나19 항체치료제가 연내 사용 가시권에 들어왔다. 국내 개발 코로나 치료제 가운데 처음으로 임상 2·3상에 진입하면서 긴급사용승인에 한 걸음 더 다가갔다.
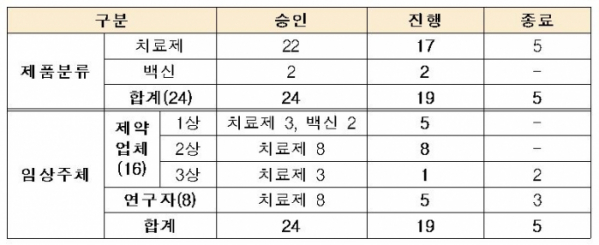
식품의약품안전처는 셀트리온이 질병관리본부와 국책과제로 개발중인 코로나19 중화항체치료제 ‘CT-P59’에 대해 2ㆍ3상 임상시험을 동시에 승인했다고 17일 밝혔다. 이로써 현재 국내에서 코로나19 관련해 임상시험이 진행 중인 치료제 및 백신은 총 19건(치료제 17건, 백신 2건)이다.
이번 임상시험은 지난 7월과 8월에 승인받은 1상 임상시험의 후속 임상시험으로, 경증부터 중등도 코로나19 환자를 대상으로 CT-P59의 유효성과 안전성을 평가하기 위한 2/3상 임상시험이다.
식약처는 건강한 사람을 대상으로 한 1상 임상시험 결과, CT-P59 투여에 따른 안전성과 내약성(약물을 투여했을 때 임상시험 대상자가 부작용이나 불편감을 견뎌낼 수 있는 정도)이 확인돼 다음 단계의 임상시험을 진행하는 것이 가능하다고 판단했다.
특히, 이번 임상시험은 2상과 3상을 동시에 승인한 것으로 2상에서 300명을 대상으로 코로나19 치료를 위한 적절한 투여 용량과 치료효과를 탐색하고, 확인된 용량을 바탕으로 유효성과 안전성 확증을 위한 3상 임상시험을 720명을 대상으로 연속해서 진행하게 된다.
이번에 승인한 ‘CT-P59’는 셀트리온에서 신약으로 개발 중인 유전자재조합 중화항체치료제다. 치료원리는 코로나19 바이러스의 표면에 있는 인체 세포와 결합하는 부위에 항체치료제가 대신 붙으면서 감염을 막게 된다. ‘CT-P59’는 미국, 루마니아 등 5개국에도 동시에 임상시험계획을 신청했다. 해외에서도 미국 일라이릴리사와 리제네론사가 코로나19 중화항체치료제를 개발해 환자를 대상으로 한 임상시험을 진행하고 있다.

![잠자던 내 카드 포인트, ‘어카운트인포’로 쉽게 조회하고 현금화까지 [경제한줌]](https://img.etoday.co.kr/crop/140/88/2100528.jpg)
!['20년 째 공회전' 허울 뿐인 아시아 금융허브의 꿈 [외국 금융사 脫코리아]](https://img.etoday.co.kr/crop/140/88/2100022.jpg)
![[단독]"한 번 뗄 때마다 수 백만원 수령 가능" 가짜 용종 보험사기 기승](https://img.etoday.co.kr/crop/140/88/2100020.jpg)
![8만 달러 터치한 비트코인, 연내 '10만 달러'도 넘보나 [Bit코인]](https://img.etoday.co.kr/crop/140/88/2100256.jpg)

![환자복도 없던 우즈베크에 ‘한국식 병원’ 우뚝…“사람 살리는 병원” [르포]](https://img.etoday.co.kr/crop/140/88/2099863.jpg)
![불 꺼진 복도 따라 ‘16인실’ 입원병동…우즈베크 부하라 시립병원 [가보니]](https://img.etoday.co.kr/crop/140/88/2099872.jpg)
![“과립·멸균 생산, 독보적 노하우”...‘단백질 1등’ 만든 일동후디스 춘천공장 [르포]](https://img.etoday.co.kr/crop/140/88/2099348.jpg)














![잠자던 내 카드 포인트, ‘어카운트인포’로 쉽게 조회하고 현금화까지 [경제한줌]](https://img.etoday.co.kr/crop/300/170/2100528.jpg)
![코스피 1% 이상 하락... 2531.66에 마감 [포토]](https://img.etoday.co.kr/crop/300/190/2100641.jpg)