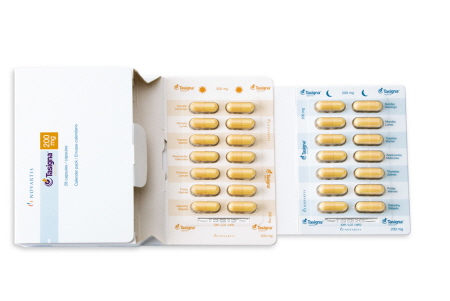
노바티스의 차세대 백혈병 치료제 타시그나(성분명: 닐로티닙)가 일본에서 새롭게 진단된 만성골수성백혈병 만성기 환자의 1차 치료제로 승인 받았다. 이번 승인은 타시그나 제 3상 임상연구인 ENESTnd의 결과를 근거로 기존의 표준치료제인 글리벡보다 뛰어난 효과를 보이는 것으로 밝혀져 1차 치료제로서의 가치를 인정받은 것이다.
1차 치료제란 병이 발생했을 때 처방하는 약이다. 그동안 타그시나는 글리벡을 사용한 환자가 부작용을 일으킬 때 대신 처방하던 2차 치료제였다.
NESTnd는 만성골수성백혈병 만성기 환자를 대상으로 타시그나의 1차 치료효과를 평가하기 위해 기존 표준치료제 글리벡과 직접 비교한 최초의 대규모 글로벌 임상연구다.
연구 결과 타시그나는 기존의 치료제인 글리벡보다 발병 원인 암유전자를 더 빠르고 심도 있게 제거할 뿐만 아니라 부작용이 적은 것으로 나타났다. 또한 질병이 진행된 환자 수도 타시그나가 글리벡보다 유의하게 적은 것으로 나타났다. 이 약은 하루에 한 알씩 총 2회에 걸쳐 복용한다.
타시그나는 지난 6월 미국 식약청(FDA)에서 만성골수성백혈병 1차 치료제로 승인된 데 이어 스위스를 거쳐 이번에 일본에서 승인이 됐다. 또 국내를 비롯한 세계 각국에서 승인을 검토중에 있다.
ENESTnd 연구결과는 미국 식약청의 승인을 받을 당시 학계 최고의 권위지인 NEJM지에 12개월 치 결과가 실리면서 처음으로 공개됐고 같은 달 미국임상종양학회(ASCO)에서 18개월 치 결과가 발표되기도 했다.
최근에는 세계 최대 혈액질환 관련 학회인 미국혈액학회(ASH)에서 24개월 치 연구결과가 발표되어 주목을 받았다.
ENESTnd 연구는 전 세계 217센터에서 846명의 환자들을 대상으로 실시된 대규모 임상연구로 국내에서는 가톨릭대학교 서울성모병원, 경북대학교병원, 전남대학교화순병원, 울산대학교 서울아산병원, 성균관대학교 삼성서울병원, 서울대학교병원 등 국내 6개 병원에서 58명의 환자가 참여했다.

![다 상술인건 알지만…"OO데이 그냥 넘어가긴 아쉬워" [데이터클립]](https://img.etoday.co.kr/crop/140/88/2102336.jpg)
![‘2025 수능 수험표’ 들고 어디 갈까?…수험생 할인 총정리 [그래픽 스토리]](https://img.etoday.co.kr/crop/140/88/2102319.jpg)










![10만 달러 앞둔 비트코인 3.5% 급락…"시장 과열됐다" [Bit코인]](https://img.etoday.co.kr/crop/85/60/2102586.jpg)






![다 상술인건 알지만…"OO데이 그냥 넘어가긴 아쉬워" [데이터클립]](https://img.etoday.co.kr/crop/300/170/2102336.jpg)
!['수능 끝, 홀가분해요' [포토]](https://img.etoday.co.kr/crop/300/190/2102419.jpg)