
삼성바이오에피스의 아달리무맙(휴미라) 바이오시밀러 SB5 고동도 제형도 기존 저농도 제형과 유사한 수준의 약물학적 동등성과 안전성, 내약성이 있는 것으로 확인됐다. 삼성바이오에피스는 이러한 내용의 SB5 고농도 제형 1상 임상시험 결과를 발표했다.
덴마크 코펜하겐에서 1일부터 4일까지 열리고 있는 유럽류마티스학회 연례학술회의(Annual European Congress of Rheumatology, EULAR 2022)에서 삼성바이오에피스 품질평가팀과 제품평가팀은 1일(현지시간) 오후 포스터 발표(POS0641)로 해당 임상결과를 공개했다.
이번 임상은 건강한 남성을 대상으로 SB5의 저농도(LC) 제형(40mg/0.8mL)과 고농도(HC) 제형(40mg/0.4mL)에 대한 안전성, 내약성을 비교한 1상 임상시험이다. 임상시험은 저농도와 고동도 SB5 2개 그룹으로 나눈 후 1대1 비율로 주사 후 약동학적 안전성과 면역원성 등을 57일 동안 관찰해 분석했다.
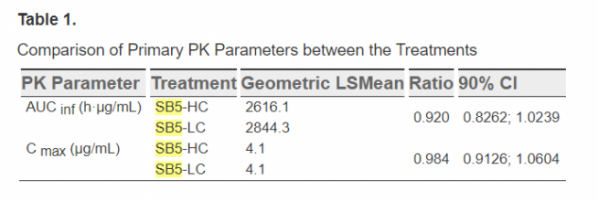
SB5 저농도 제형은 류마티스 관절염 환자를 대상으로 개발된 아달리무맙 바이오시밀러로, 2017년 1상 임상연구에서 약물학적 동등성이 입증됐다. 또한 2018년 6월 3상 임상연구를 통해 아달리무맙과의 동등한 효능과 안전성도 입증된 바 있다. 유럽에서 2017년 8월 임랄디로 승인돼 바이오젠을 통해 출시했다. 미국에서도 하드리마로 식품의약국(FDA) 승인을 받아 내년 출시를 앞두고 있다.

![세계 야구 최강국 가리는 '프리미어12'…한국, 9년 만의 우승 가능할까 [이슈크래커]](https://img.etoday.co.kr/crop/140/88/2100678.jpg)
![‘뉴롯데’ 시즌2 키 잡는 신유열...혁신 속도 [3세 수혈, 달라진 뉴롯데]](https://img.etoday.co.kr/crop/140/88/1974471.jpg)
!['트럼프 랠리'에 8만9000달러 넘어선 비트코인, 어디까지 갈까 [Bit코인]](https://img.etoday.co.kr/crop/140/88/2100928.jpg)

![긁어 부스럼 만든 발언?…‘티아라 왕따설’ 다시 뜨거워진 이유 [해시태그]](https://img.etoday.co.kr/crop/140/88/2100644.jpg)
![뉴욕 한복판에 긴 신라면 대기줄...“서울 가서 또 먹을래요”[가보니]](https://img.etoday.co.kr/crop/140/88/2100745.jpg)

![[글로벌마켓 모닝 브리핑] ‘트럼프 랠리’에 기록 대행진…다우 사상 첫 4만4000선 돌파](https://img.etoday.co.kr/crop/140/88/2100761.jpg)






![현대차·도요타도 공장 세우는 ‘인도’…14억 인구 신흥시장 ‘공략’ [모빌리티]](https://img.etoday.co.kr/crop/85/60/2100567.jpg)


![정부가 인증한 배터리, '70조' 재활용 시장 열까 [모빌리티]](https://img.etoday.co.kr/crop/85/60/2100845.jpg)



![[찐코노미] "한국은 이것 가능한 유일무이한 국가"…방산주 '이렇게' 투자할 때](https://img.etoday.co.kr/crop/300/170/2100715.jpg)
![비트코인 사상 최고가 행진... 9만 달러선 코앞 [포토]](https://img.etoday.co.kr/crop/300/190/2101004.jpg)