
아이진은 12일 서울 강서구 본사에서 열린 기업설명회와 공시를 통해 EG-Mirotin 유럽 2a상 결과를 공개했다.
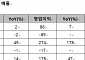
이번 2a상은 당뇨 황반부종이 있는 당뇨망막병증 환자 18명을 대상으로 EG-Mirotin을 1mg, 2mg 투여군, 위약군으로 나눠 2a상으로 나눠 진행됐다. 시험군별로 1일 1회 5일간 피하 투여해 당뇨성황반부종 환자 망막의 두께 및 부피의 변화, 혈액의 누출량 및 시력의 개선을 총 8주 동안 추적 관찰하는 임상이었다. 아이진은 당초 30명을 대상으로 임상을 계획했지만 환자 모집에 어려움을 겪으면서 18명 모집에 그쳤다.
아이진은 이번 유럽 2a상에서 통계적인 유의성을 확보하지 못했다. 김석현 연구소장은 "18명의 모집군 중 각 군당 6명으로 구성된 시험대조군의 표본수가 통계적인 유의성을 확보하기에는 적었고 시험군 간의 무작위배정으로 인해 각 시험군을 구성하는 환자의 병증의 진행 정도의 차이가 발생해 1mg, 2mg 치료군에서의 유효성 평가에 대한 한계성이 있었다"고 설명했다.
다만 투여군 모두 안전성에 문제가 없음을 확인했다. 김 연구소장은 또한 "1일 1회 5일간 투여 시, 투여 5일차에서 시험약 EG-Mirotin 1mg, 2mg 시험군이 위약군에 비해 기저치 대비 망막 부피가 더 줄어드는 현상을 확인했다"면서 "투여량과 투여시간을 증가해 추가적인 연구를 진행할 필요가 있음을 확인했다"고 말했다.
아이진은 이에 따라 올해 4분기 미국 식품의약국 EG-Mirotin 2상 승인 계획은 예정대로 진행한다는 계획이다. 아이진은 미국 2상에서는 피험자수를 100명으로 늘리고, 시험군을 EG-Mirotin 3mg 투여군과 위약군으로 구성해 1일 1회 28일 투여하는 프로토콜로 진행한다는 계획이다.
아이진은 이날 국내에서 진행한 욕창 치료제 1/2상 결과도 내놨다. 이번 임상은 만20세이상의 욕창 크기 2㎠이상 70㎠ 미만의 욕창 2단계의 해당하는 환자 118명(목표는 147명)을 대상으로 EG-Decorin을 아침/저녁으로 각각 1회당 10mg/㎠을 도포, 이를 7일, 14일, 21일, 28일 간격 총 28일 동안 추적 관찰해 적정 용법/용량 및 안전성과 유효성을 탐색하는 임상이다.
이 임상에서는 1차 목표치인 '욕창크기 변화율'은 통계적으로 유의하지는 않았다. 다만 추가적으로 실시된 탐색적 분석에서는 기저시점 욕창 크기 20㎠ 이상에서 고용량군이 모든 시점 위약군보다 통계적으로 유의한 욕창 크기 변화율을 확인했다. 김 연구소장은 "욕창치료제 EG-Decorin의 욕창 치료에 대한 단기치료 가능성을 확인했다"면서 "2009년 체결한 기술이전 계약에 근거해 휴온스와 협의를 통해 임상 3상에 진입할 계획"이라고 말했다.

![부동산 PF 체질 개선 나선다…PF 자기자본비율 상향·사업성 평가 강화 [종합]](https://img.etoday.co.kr/crop/140/88/2101720.jpg)
![[종합] EBS·입시업계 “수학, 작년보다 확실히 쉬워...변별력은 확보”](https://img.etoday.co.kr/crop/140/88/2102225.jpg)

![전기차 수준 더 높아졌다…상품성으로 캐즘 정면돌파 [2024 스마트EV]](https://img.etoday.co.kr/crop/140/88/2102282.jpg)
![낮은 금리로 보증금과 월세 대출, '청년전용 보증부월세대출' [십분청년백서]](https://img.etoday.co.kr/crop/140/88/2102283.jpg)
![[종합] ‘공직선거법 위반’ 김혜경 벌금 150만원…法 “공정성·투명성 해할 위험”](https://img.etoday.co.kr/crop/140/88/2102280.jpg)
![이혼에 안타까운 사망까지...올해도 연예계 뒤흔든 '11월 괴담' [이슈크래커]](https://img.etoday.co.kr/crop/140/88/2101314.jpg)
!["늦었다고 생각할 때가 제일 빠를 때죠" 83세 임태수 할머니의 수능 도전 [포토로그]](https://img.etoday.co.kr/crop/140/88/2101767.jpg)













![이혼에 안타까운 사망까지...올해도 연예계 뒤흔든 '11월 괴담' [이슈크래커]](https://img.etoday.co.kr/crop/300/170/2101314.jpg)
![본회의, 이재명 대표 '표정'…1심 재판 선고 D-1 [포토]](https://img.etoday.co.kr/crop/300/190/2102368.jpg)