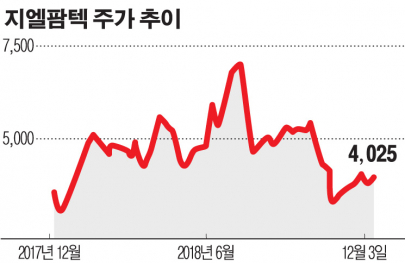
지엘팜텍이 내년 1분기 신경병성통증치료제(GLA5PR)를 국내에 출시할 전망이다. 회사 측은 건강보험 등재 등을 거쳐 기술이전 계약을 체결한 4개 제약사와 함께 시장 개척에 나선다는 구상이다. 이르면 내년 1분기부터 관련 매출이 실적에 반영돼 적자 탈출에도 청신호가 켜졌다.
회사 관계자는 3일 "현재 GLA5PR에 대해 식품의약품안전처로부터 의약품 품목허가를 기다리고 있는 상태"라며 "이달 품목 허가가 승인나면 건강보험 등재 과정을 거쳐 이르면 내년 1분기 국내 출시가 가능할 것으로 본다"고 말했다.
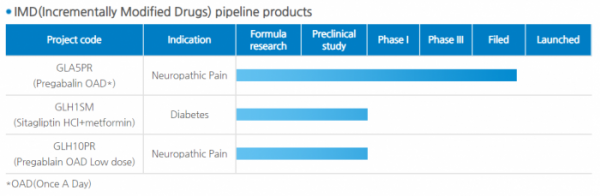
GLA5PR은 화이자의 프레가발린(제품명 리리카)을 서방형으로 만든 개량신약이다. 기존 리리카는 하루 2회 복용해야 하지만, GLARS 서방형 제제기술을 이용해 1회로 줄여 편의성을 높였다. 지난 7월 임상시험 3상을 완료했다.
회사 관계자는 "임상결과를 바탕으로 이르면 이달 말 식약처로부터 품목허가가 승인날 것으로 기대한다"며 "다수 제약사와 기술이전 계약을 통해 유통할 계획이며 이르면 내년 1분기부터 관련 매출이 실적에 반영될 가능성이 높다"고 내다봤다.
지엘팜텍은 종근당 등 4개 제약회사와 GLA5PR 관련 기술이전 계약을 체결한 상태다. 자체 영업조직이 없기 때문에 대형 제약사들과 연계해 유통 활로를 넓힌다는 구상이다. 현재 1개사와 추가 계약을 논의하고 있다.
프레가발린 복제약 시장은 지난해 8월 용도 특허까지 만료되면서 경쟁이 날로 치열해지고 있다. 국내에서는 지엘팜텍, 화이자, 유한양행 등이 프레가발린 서방형 출시를 두고 경쟁하고 있다. 지난해 국내 프레가발린 시장 규모는 유비스트 기준 665억 원, 올해 상반기에는 390억 원 규모로 집계됐다.
국내 출시에 이어 미국 식품의약처(FDA)와 임상시험 관련한 사전 미팅(Pre-IND Meeting)도 동시에 진행하고 있다. 현재 미팅 수락 공문을 받았으며 FDA의 의견을 듣기 위해 추가로 필요한 자료 등을 파악하고 있다고 설명했다.
지엘팜텍 관계자는 "국내에서 진행한 임상시험 자료를 토대로 인정받는 부분과 추가 보완해야 할 부분 등에 대한 의견을 받고 있다"며 "이르면 연내 GLA5PR 임상 관련한 의견을 받고, 향후 미국시장 진출을 구체화할 계획"이라고 말했다.

![세계 야구 최강국 가리는 '프리미어12'…한국, 9년 만의 우승 가능할까 [이슈크래커]](https://img.etoday.co.kr/crop/140/88/2100678.jpg)
![‘뉴롯데’ 시즌2 키 잡는 신유열...혁신 속도 [3세 수혈, 달라진 뉴롯데]](https://img.etoday.co.kr/crop/140/88/1974471.jpg)
!['트럼프 랠리'에 8만9000달러 넘어선 비트코인, 어디까지 갈까 [Bit코인]](https://img.etoday.co.kr/crop/140/88/2100928.jpg)

![긁어 부스럼 만든 발언?…‘티아라 왕따설’ 다시 뜨거워진 이유 [해시태그]](https://img.etoday.co.kr/crop/140/88/2100644.jpg)
![뉴욕 한복판에 긴 신라면 대기줄...“서울 가서 또 먹을래요”[가보니]](https://img.etoday.co.kr/crop/140/88/2100745.jpg)

![[글로벌마켓 모닝 브리핑] ‘트럼프 랠리’에 기록 대행진…다우 사상 첫 4만4000선 돌파](https://img.etoday.co.kr/crop/140/88/2100761.jpg)










![[특징주] 삼성출판사 ‘핑크퐁 공룡유치원’ 넷플릭스 키즈 1위 소식에 급등](https://img.etoday.co.kr/crop/85/60/2100940.jpg)

![[오늘 신상] 고려저축은행, 최대 연 6% 적금 2종 출시](https://img.etoday.co.kr/crop/85/60/2100929.jpg)
![[찐코노미] "한국은 이것 가능한 유일무이한 국가"…방산주 '이렇게' 투자할 때](https://img.etoday.co.kr/crop/300/170/2100715.jpg)
![대장동 배임·성남FC 뇌물 1심 속행 공판 출석하는 이재명 대표 [포토]](https://img.etoday.co.kr/crop/300/190/2100957.jpg)