
서 회장은 이날 2차 온라인 기자간담회를 통해 코로나19 치료제 개발 현황을 공개했다. 서 회장은 앞선 12일 코로나19 항체 치료제 및 신속진단키트를 개발하겠다고 선언한 바 있다.
셀트리온은 이후 코로나19 회복 환자의 혈액에서 항체 후보군(라이브러리)을 구축하고 항원에 결합하는 300종의 항체를 확보했다. 질병관리본부로부터 환자 면역세포 수령 후 3주 만에 치료제 개발에 핵심적인 첫 단계를 완료했다.
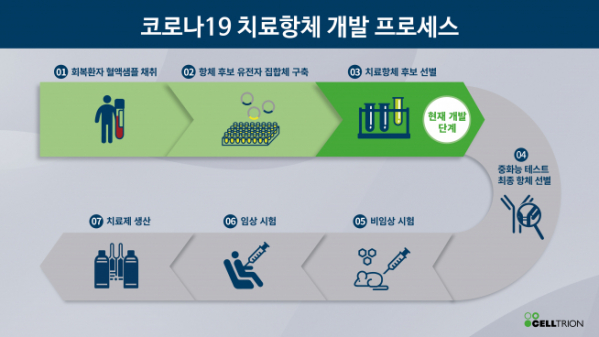
또한 셀트리온의 자체 특허 기술인 고(高)발현 벡터를 적용한 세포주 개발, 생산 공정 개발, 제품 품질 보증을 위한 분석법 개발, 임상에 적용될 제형 등의 개발을 거의 같은 시기에 진행해, 비임상 및 임상 진입을 최대한 앞당긴다는 전략을 세워놓고 있다.
서 회장은 "빠르면 오늘 7월 말부터 인체 투여가 가능한 제품을 개발하는 것이 목표"라면서 "임상 1상을 최단시간에 진행하고 유관기관과 협의해 2, 3상을 진행할 계획"이라고 말했다. 유럽의약품청(EMA), 미국 식품의약품국(FDA) 등 해외 주요 허가기관들의 지원 아래 글로벌 임상 계획도 병행하면서 치료제의 해외 공급을 준비할 예정이라고 설명했다. 셀트리온은 1개월에 약 100만명 분의 치료용 항체를 공급하는 대량생산 계획도 세워놨다.

셀트리온 연구진은 최종 치료 항체가 선정되면 이 항체가 가지는 백신 유사효과에도 주목하고 있다. 백신의 목적도 체내 항체 생성이므로 치료용 항체를 투여하면 백신과 유사한 예방 효과를 낼 수 있어 관련 연구를 병행한다는 계획이다.
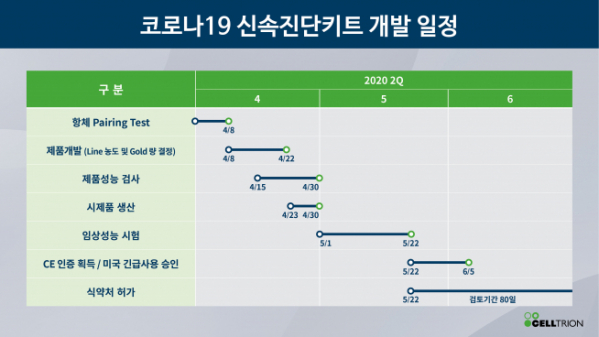
셀트리온은 코로나19 진단키트 개발에도 속도를 내고 있다. 특히 셀트리온이 개발 중인 제품은 코로나19에만 존재하는 S단백질을 검출하는 방식이어서 코로나19 양성 판정 표준 진단법인 RT-PCR에 근접한 성능을 보여줄 수 있다는 설명이다.
서 회장은 "4월 말 시제품 생산을 완료하고 5월 말까지 임상을 완료해 유럽 수출용 CE인증 을 필두로 한국과 미국에서도 유관기관에 인증을 신청할 계획"이라면서 "인증이 완료되는 즉시 유럽, 미국, 중동 지역 국가들에 우선 보급해, 코로나19의 전세계적 확산 속도를 낮추는 데 일조한다는 계획"이라고 덧붙였다.

![긁어 부스럼 만든 발언?…‘티아라 왕따설’ 다시 뜨거워진 이유 [해시태그]](https://img.etoday.co.kr/crop/140/88/2100644.jpg)
![잠자던 내 카드 포인트, ‘어카운트인포’로 쉽게 조회하고 현금화까지 [경제한줌]](https://img.etoday.co.kr/crop/140/88/2100528.jpg)
![[단독]"한 번 뗄 때마다 수 백만원 수령 가능" 가짜 용종 보험사기 기승](https://img.etoday.co.kr/crop/140/88/2100020.jpg)
![8만 달러 터치한 비트코인, 연내 '10만 달러'도 넘보나 [Bit코인]](https://img.etoday.co.kr/crop/140/88/2100256.jpg)

![환자복도 없던 우즈베크에 ‘한국식 병원’ 우뚝…“사람 살리는 병원” [르포]](https://img.etoday.co.kr/crop/140/88/2099863.jpg)






![“책임경영 시급…롯데판 ‘프랑크푸르트 선언’ 절실” [3세 수혈, 달라진 뉴롯데]](https://img.etoday.co.kr/crop/85/60/2053752.jpg)
![“결국은 실적”...보신주의 깨고 ‘성과주의’ 페달 밟나 [3세 수혈, 달라진 뉴롯데]](https://img.etoday.co.kr/crop/85/60/2100738.jpg)


![‘뉴롯데’ 시즌2 키 잡는 신유열...혁신 속도 [3세 수혈, 달라진 뉴롯데]](https://img.etoday.co.kr/crop/85/60/1974471.jpg)

![뉴욕 한복판에 긴 신라면 대기줄...“서울 가서 또 먹을래요”[가보니]](https://img.etoday.co.kr/crop/85/60/2100745.jpg)



![[찐코노미] "한국은 이것 가능한 유일무이한 국가"…방산주 '이렇게' 투자할 때](https://img.etoday.co.kr/crop/300/170/2100715.jpg)
![코스피 1% 이상 하락... 2531.66에 마감 [포토]](https://img.etoday.co.kr/crop/300/190/2100641.jpg)