신약 개발에 사활을 건 주요 바이오 기업들이 적자의 수렁에서 헤어나오지 못하고 있다. 대부분 손실 규모에 비해 뾰족한 성과가 없어 회복이 가능할지 우려된다.
26일 금융감독원 전자공시시스템에 따르면 신라젠과 에이치엘비, 헬릭스미스, 강스템바이오텍 등 신약 임상 3상 단계의 바이오 기업들이 지난해 적자를 이어갔다. 이들은 기대에 미치지 못하는 임상 성과를 내놓으면서 실적이 악화됐다.
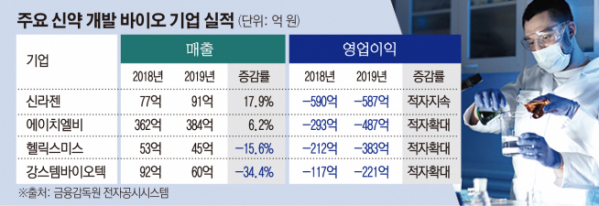
신라젠은 지난해 영업손실 587억 원을 기록했다. 전년도 영업손실과 비슷한 규모다. 당기순손실은 1196억 원으로 2배 이상 늘었다. ‘펙사벡’ 임상 3상 실패의 여파다.
미국 데이터모니터링위원회(DMC)는 지난해 8월 펙사벡의 간암 대상 임상 3상 시험에 대한 무용성 평가 결과 임상 중단을 권고했다. 이에 따라 신라젠은 전 세계 600여 명의 환자를 대상으로 한 대규모 임상의 투자금을 비용으로 처리했다.
2016년 상장한 신라젠은 그해 468억 원, 이듬해 506억 원, 2018년 590억 원의 영업손실을 냈다. 이에 비해 매출액은 지난해에도 겨우 91억 원에 불과했다.
신라젠은 여전히 단일 파이프라인인 펙사벡에 의존하고 있다. 간암에서는 실패했지만, 펙사벡과 면역관문 억제제의 병용 임상을 통해 신장암, 대장암, 유방암 등의 치료제를 개발한다는 계획이다. 그러나 모두 임상 초기 단계이고, 막대한 비용을 조달해야 한다는 점에서 전망은 그리 밝지 않은 편이다.
에이치엘비는 2015년부터 지난해까지 5년 연속 적자를 기록하고 있다. 2018년 293억 원이던 영업손실은 지난해 487억 원으로 불어났다. 최근 5개년 중 최대 규모다. 회사는 연구개발비 증가가 실적 부진의 주요인이라고 설명했다.
지난해 6월 글로벌 경구용 항암제 ‘리보세라닙’의 임상 3상 톱라인 데이터를 내놨던 에이치엘비는 9월 결과를 완전히 뒤집어 종양의 완전한 소멸 사례 및 부작용 측면에서 효율성과 안전성을 증명해 임상 3상이 성공했다고 발표했다. 현재 미국 식품의약국(FDA) 위암 3차 치료제로 신약허가신청(NDA) 절차를 준비하고 있다. 최근에는 면역치료 플랫폼 기술을 보유한 미국의 바이오 기업 이뮤노픽 테라퓨틱스를 인수해 단일 파이프라인의 약점 극복을 시도했다.
당뇨병성신경병증 치료제 후보물질 ‘엔젠시스(VM202)’를 보유한 헬릭스미스도 적자 규모가 늘었다. 지난해 영업손실은 383억 원으로, 전년 대비 171억 원 증가했다. 매출은 2018년 53억 원에서 2019년 45억 원으로 줄었다.
헬릭스미스는 엔젠시스의 임상 3상이 주요 지표를 달성하지 못하면서 개발비를 비용처리했다. 그러나 안전성과 유효성은 달성했다는 판단하에 후속 임상 3상을 추진하고 있다. 이를 위해 글로벌 전문가들을 차례로 영입, 이르면 다음 달 임상에 들어간다.
회사는 기존 임상 3상에서 발견된 약동학 분석 이상 현상에 대한 조사를 마친 만큼 후속 임상을 더욱 면밀히 진행해 예정보다 빠른 2021년 하반기 미국 FDA에 시판허가(BLA)를 낼 계획이다. 하지만 조사를 거쳐 환자 간 약물 혼용으로 임상 3상이 실패했다는 기존 주장을 바꿔 ‘통증이란 지표의 특수성과 임상 운영 방법상의 문제’란 모호한 결론을 내려 업계에 혼란을 줬다.
줄기세포치료제 개발 기업 강스템바이오텍 역시 영업손실 221억 원으로 적자폭을 키웠다. 회사는 아토피피부염 줄기세포치료제 ‘퓨어스템-AD’의 국내 임상 3상에서 통계적 유의성을 확보하지 못했다. 여기에 퓨어스템-AD의 성공을 염두에 두고 신축한 공장의 운영비가 발생하면서 손실이 커졌다. 설상가상으로 매출을 책임지던 화장품 사업도 중국 내수 침체 등으로 부진해 매출 규모도 30% 이상 쪼그라들었다.
강스템바이오텍은 퓨어스템-AD의 임상 3상 재개에 나선다고 24일 밝혔다. 병용금지 예외 약물이 줄기세포치료제와 약물 상호 간섭작용을 일으켜 약효가 저해되는 것을 개선하고, 줄기세포치료제의 제조 후 투여까지 소요 시간을 줄이는 등 재임상에서 유효성을 높이기 위한 작업을 진행했다.
업계 관계자는 “대다수 바이오 기업은 매출이 미미하고 단일 파이프라인의 성공 가능성에 의존하고 있다”면서 “신약 개발로 성과를 내지 못하면 돌파구를 찾기 어려울 것”이라고 진단했다.

![잠자던 내 카드 포인트, ‘어카운트인포’로 쉽게 조회하고 현금화까지 [경제한줌]](https://img.etoday.co.kr/crop/140/88/2100528.jpg)
!['20년 째 공회전' 허울 뿐인 아시아 금융허브의 꿈 [외국 금융사 脫코리아]](https://img.etoday.co.kr/crop/140/88/2100022.jpg)
![[단독]"한 번 뗄 때마다 수 백만원 수령 가능" 가짜 용종 보험사기 기승](https://img.etoday.co.kr/crop/140/88/2100020.jpg)
![8만 달러 터치한 비트코인, 연내 '10만 달러'도 넘보나 [Bit코인]](https://img.etoday.co.kr/crop/140/88/2100256.jpg)

![환자복도 없던 우즈베크에 ‘한국식 병원’ 우뚝…“사람 살리는 병원” [르포]](https://img.etoday.co.kr/crop/140/88/2099863.jpg)
![불 꺼진 복도 따라 ‘16인실’ 입원병동…우즈베크 부하라 시립병원 [가보니]](https://img.etoday.co.kr/crop/140/88/2099872.jpg)
![“과립·멸균 생산, 독보적 노하우”...‘단백질 1등’ 만든 일동후디스 춘천공장 [르포]](https://img.etoday.co.kr/crop/140/88/2099348.jpg)














![잠자던 내 카드 포인트, ‘어카운트인포’로 쉽게 조회하고 현금화까지 [경제한줌]](https://img.etoday.co.kr/crop/300/170/2100528.jpg)
![코스피 1% 이상 하락... 2531.66에 마감 [포토]](https://img.etoday.co.kr/crop/300/190/2100641.jpg)