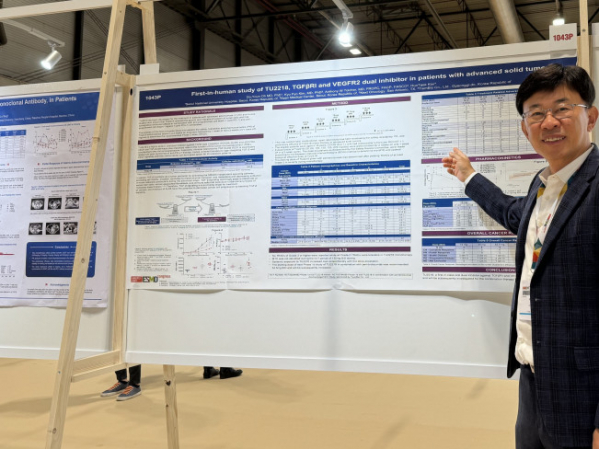
티움바이오는 유럽종양학회(European Society for Medical Oncology, ESMO)에서 면역항암제 ‘TU2218’의 단독 투여 임상인 임상 1a상 데이터를 23일(현지시간) 발표했다고 24일 밝혔다.
티움바이오에 따르면, TU2218은 경구용 이중 저해제(dual inhibitor)로, 종양미세환경 내 면역항암제의 활성을 방해하는 ‘TGF-ß’와 종양세포 주변 혈관생성 인자인 ‘VEGF’를 동시에 차단해 키트루다(Keytruda) 등 면역항암제에 불응하거나 치료 효과가 높지 않은 환자들의 반응률을 효과적으로 개선해 줄 것이라 기대되는 차세대 치료제다.
이번 ESMO에서 TU2218의 임상 1a상 연구책임자인 오도연 서울대병원 종양내과 교수가 TU2218의 첫 임상 데이터 발표를 맡았다. 오 교수는 “TU2218의 첫 환자 대상 임상에서 하루 30㎎부터 시작해 270㎎까지 용량을 증가시키며 투약을 진행했는데 용량제한독성(dose limiting toxicity, DLT)이 나타나지 않았고, grade 3 이상의 약물 관련 부작용이 없어 이번 임상의 주요 목적인 TU2218의 안전성과 내약성을 확인할 수 있었다”고 설명했다.
김훈택 티움바이오 대표는 “TU2218이 면역항암제와 병용했을 때 탁월한 항암효과를 동물실험에서 이끌어낸 데 이어, 암 환자 대상으로 진행된 첫 임상에서 신약의 안전성과 키트루다 병용 투약을 위한 용량 확인 등 중요한 마일스톤을 달성했다”며 “임상에서 확인된 데이터를 토대로 키트루다와 병용 개발을 통해 기존 치료제에 반응하지 않는 암 환자들에게 혁신적인 치료제를 제공할 것”이라고 전했다.
TU2218 임상 1a상은 미국과 한국에서 총 22명의 진행성 고형암(advanced solid tumor) 환자 대상으로 하루 30㎎(15㎎ 하루 두 번 투약)부터 270㎎(135㎎ 하루 두 번 투약)까지 총 6단계 용량 단계별 투약을 진행했다.
한편, 티움바이오는 현재 미국 내 임상기관 3곳에서 TU2218과 키트루다 병용투여 임상 1b상을 진행 중이며 내년 초 임상 결과 도출을 앞두고 있다. 또한, 고형암 환자를 대상으로 내년 상반기 임상 2a상 진입을 앞두고 있다. 임상시험에서 사용되는 키트루다는 작년 6월 글로벌 제약사 머크(MSD)와 체결한 ‘임상시험 협력 및 공급계약’을 통해 무상지원 받고 있다.

![긁어 부스럼 만든 발언?…‘티아라 왕따설’ 다시 뜨거워진 이유 [해시태그]](https://img.etoday.co.kr/crop/140/88/2100644.jpg)
![잠자던 내 카드 포인트, ‘어카운트인포’로 쉽게 조회하고 현금화까지 [경제한줌]](https://img.etoday.co.kr/crop/140/88/2100528.jpg)
![[단독]"한 번 뗄 때마다 수 백만원 수령 가능" 가짜 용종 보험사기 기승](https://img.etoday.co.kr/crop/140/88/2100020.jpg)
![8만 달러 터치한 비트코인, 연내 '10만 달러'도 넘보나 [Bit코인]](https://img.etoday.co.kr/crop/140/88/2100256.jpg)

![환자복도 없던 우즈베크에 ‘한국식 병원’ 우뚝…“사람 살리는 병원” [르포]](https://img.etoday.co.kr/crop/140/88/2099863.jpg)





!["한국은 '이것' 가능한 유일무이한 국가" 방산주 '이렇게' 투자할 때입니다 ㅣ 이영훈 이사 [찐코노미]](https://i.ytimg.com/vi/B9X9jpK5FGE/mqdefault.jpg)










![[찐코노미] "한국은 이것 가능한 유일무이한 국가"…방산주 '이렇게' 투자할 때](https://img.etoday.co.kr/crop/300/170/2100715.jpg)
![코스피 1% 이상 하락... 2531.66에 마감 [포토]](https://img.etoday.co.kr/crop/300/190/2100641.jpg)