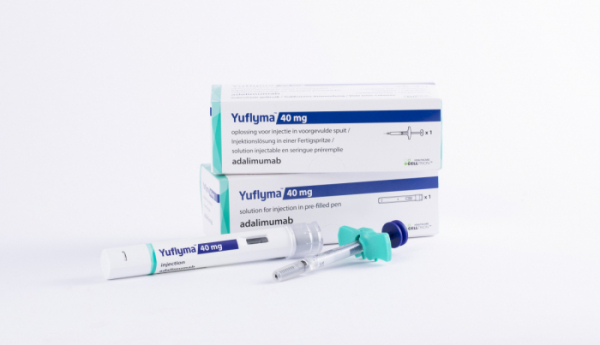
셀트리온은 2일 유럽 류마티스학회(EULAR)에서 자가면역질환 치료제 휴미라 고농도 바이오시밀러 ‘유플라이마(Yyflyma, CT-P17)의 임상 3상 결과를 발표했다고 밝혔다.
발표에 따르면 셀트리온은 유플라이마의 임상 3상을 52주 동안 진행해 유효성(Efficacy), 약동학(PK), 면역원성(Immunogenicity)을 포함한 전반적인 안전성(Safety)을 평가했다.
그 결과 셀트리온은 유플라이마 투약군, 휴미라 투약군, 휴미라 투약 26주 후 유플라이마 교체투약군 등 3그룹에서 모두 유사한 유효성 및 약동학, 안전성 결과를 확인했다. 특히 교체 투약 후 항체 생성에 따른 면역원성 증가가 나타나지 않는 등 3군 사이의 유의미한 차이는 없었다고 셀트리온은 설명했다.
셀트리온 관계자는 “이번 학회 발표를 통해 휴미라 바이오시밀러 최초 고농도 제형 제품으로 개발된 유플라이마의 효능과 안전성을 증명하게 됐다”며 “고농도 휴미라 바이오시밀러를 기다려온 유럽 의료진과 환자들에게 차별화된 경쟁력을 갖춘 유플라이마를 빠르게 공급함으로써 합리적인 가격에 고품질 바이오의약품의 혜택을 지속 제공할 계획”이라고 말했다.
한편 유플라이마는 고농도 제형의 휴미라 바이오시밀러로 약물 투여량을 절반으로 줄이고 주사 시 통증을 유발할 수 있는 시트르산염을 제거한 것이 특징이다.

![긁어 부스럼 만든 발언?…‘티아라 왕따설’ 다시 뜨거워진 이유 [해시태그]](https://img.etoday.co.kr/crop/140/88/2100644.jpg)
![잠자던 내 카드 포인트, ‘어카운트인포’로 쉽게 조회하고 현금화까지 [경제한줌]](https://img.etoday.co.kr/crop/140/88/2100528.jpg)
![[단독]"한 번 뗄 때마다 수 백만원 수령 가능" 가짜 용종 보험사기 기승](https://img.etoday.co.kr/crop/140/88/2100020.jpg)
![8만 달러 터치한 비트코인, 연내 '10만 달러'도 넘보나 [Bit코인]](https://img.etoday.co.kr/crop/140/88/2100256.jpg)

![환자복도 없던 우즈베크에 ‘한국식 병원’ 우뚝…“사람 살리는 병원” [르포]](https://img.etoday.co.kr/crop/140/88/2099863.jpg)





!["한국은 '이것' 가능한 유일무이한 국가" 방산주 '이렇게' 투자할 때입니다 ㅣ 이영훈 이사 [찐코노미]](https://i.ytimg.com/vi/B9X9jpK5FGE/mqdefault.jpg)










![[찐코노미] "한국은 이것 가능한 유일무이한 국가"…방산주 '이렇게' 투자할 때](https://img.etoday.co.kr/crop/300/170/2100715.jpg)
![코스피 1% 이상 하락... 2531.66에 마감 [포토]](https://img.etoday.co.kr/crop/300/190/2100641.jpg)