한국노바티스의 척수성 근위축증 유전자치료제 ‘졸겐스마주’가 국내 두 번째 첨단바이오의약품으로 허가받았다.
식품의약품안전처는 한국노바티스가 허가 신청한 ‘졸겐스마주(오나셈노진아베파르보벡)’를 지난해 8월 첨단재생바이오법 시행 이후 두 번째 첨단바이오의약품으로 허가했다고 28일 밝혔다.
앞서 식약처는 3월 한국노바티스의 키메라 항원 수용체 T세포(CAR-T) 치료제 ‘킴리아주(티사젠렉류셀)’를 첨단재생바이오법에 따른 제1호 첨단바이오의약품으로 허가한 바 있다.
이번에 허가한 ‘졸겐스마주’는 결함이 있는 유전자를 기능적으로 대체하는 유전물질이 포함된 유전자치료제로, 첨단바이오의약품에 해당한다. 첨단바이오의약품은 살아있는 세포ㆍ조직이나 유전물질 등을 원료로 한 세포치료제ㆍ유전자치료제 등으로 첨단재생바이오법에 따라 장기 추적조사 등 차별화된 안전관리, 연구개발ㆍ제품화 지원 등을 받을 수 있다.
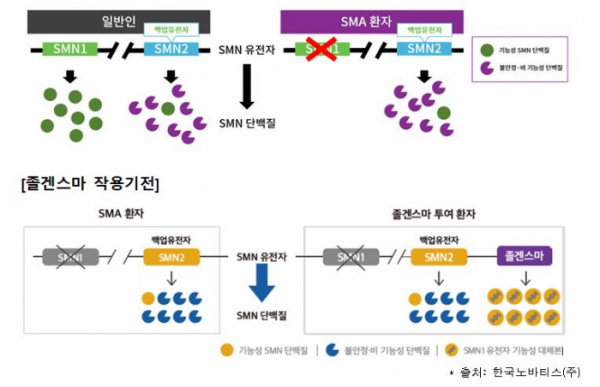
‘졸겐스마주’는 생존운동뉴런1(SMN1) 유전자가 돌연변이 등으로 기능을 하지 못해 발생하는 퇴행성 신경질환 ‘척수성 근위축증(SMA)’ 환자에게 정맥으로 단회 투여하는 치료제다. 환자는 기능을 하지 못하는 생존운동뉴런1(SMN1) 유전자 대신 사람생존운동뉴런(hSMN) 유전자를 운반체(벡터)로 전달받아 중추신경계 운동신경세포에서 생존운동뉴런(SMN) 단백질을 만들 수 있게 된다.
이 약은 생존운동뉴런1(SMN1) 유전자에 이중대립형질 돌연변이가 있는 척수성 근위축증 환자 중에서 △제1형 척수성 근위축증 임상적 진단이 있거나 △생존운동뉴런2(SMN2) 유전자의 복제수가 3개 이하인 경우에 사용하도록 허가됐다.
식약처는 첨단재생바이오법의 심사기준에 따라 신청 의약품에 대한 품질, 안전성ㆍ효과성, 시판 후 안전관리계획 등에 대해 과학적으로 철저하게 심사하고 평가했다.
이 약은 첨단재생바이오법 제30조에 따른 ‘장기추적조사’ 대상 의약품으로 투여일에서 15년간 이상사례 등을 추적해야 하고 처음 판매한 날부터 1년마다 장기 추적조사한 내용과 결과 등을 식약처에 보고해야 한다.
식약처는 “이번 품목 허가로 치명적 질환인 척수성 근위축증 환자들에게 새로운 치료 기회를 제공할 수 있을 것으로 기대하며, 앞으로도 첨단바이오의약품을 신속하게 허가하고 제품을 안전하게 관리해 희귀ㆍ난치환자에게 새로운 치료 기회를 제공하도록 노력하겠다”라고 말했다.

![어떤 주담대 상품 금리가 가장 낮을까? ‘금융상품 한눈에’로 손쉽게 확인하자 [경제한줌]](https://img.etoday.co.kr/crop/140/88/2101515.jpg)
![2025 수능 시험장 입실 전 체크리스트 [그래픽 스토리]](https://img.etoday.co.kr/crop/140/88/2101156.jpg)
!["최강야구 그 노래가 애니 OST?"…'어메이징 디지털 서커스'를 아시나요? [이슈크래커]](https://img.etoday.co.kr/crop/140/88/2101671.jpg)


















![[찐코노미] 美 취약점을 파고든 K방산의 미래…차기 방산 대장주는 '이것'?](https://img.etoday.co.kr/crop/300/170/2101653.jpg)
![예결위, 비경제부처 예산심사 첫날 [포토]](https://img.etoday.co.kr/crop/300/190/2101714.jpg)