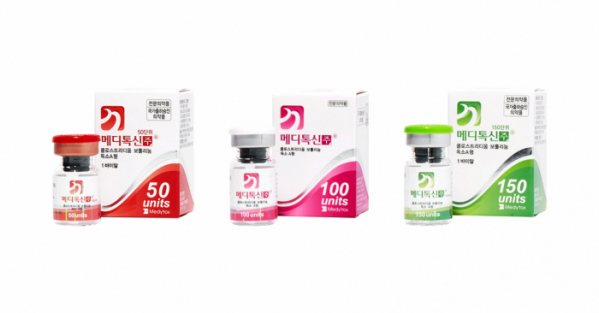
메디톡스의 보툴리눔 톡신 제제 전 품목이 허가 취소 위기에 몰렸다. 현재 메디톡스가 판매 중인 보툴리눔 톡신 제제는 메디톡신 4개 용량(50단위, 100단위, 150단위, 200단위)과 코어톡스, 이노톡스인데 앞서 식품의약품안전처가 메디톡신 4개 용량과 코어톡스 품목허가 취소처분을 내린 데 이어 이노톡스까지 품목허가 취소처분을 결정함으로써 메디톡스 보툴리눔 톡신 제제 전 품목이 시장에서 퇴출당할 전망이다.
식약처는 22일 메디톡스가 생산하는 이노톡스주를 잠정 제조ㆍ판매ㆍ사용을 중지하고 품목허가 취소 등 행정처분에 착수한다고 밝혔다.
이번 처분은 국민권익위원회에 공익신고로 제보된 ‘이노톡스주’의 허가 제출 서류 조작 의혹에 대한 검찰 수사 결과에 따른 것으로, 검찰은 메디톡스가 의약품 품목허가 및 변경허가를 하는 과정에서 안정성 시험 자료를 위조한 위반행위를 확인했다. 이에 검찰은 형법 제137조에 따른 위계에 의한 공무집행방해로 메디톡스를 재판에 넘겼다.
식약처는 검찰에서 인허가 범죄사실 통지(공소장)를 받아 해당 품목 및 위반사항을 확인했고, 메디톡스가 거짓이나 그 밖의 부정한 방법으로 품목허가 및 변경허가를 받은 경우(약사법 제76조 제1항 2의3)에 해당한다고 판단해 품목허가 취소 절차에 착수했다.
식약처는 허가취소 행정절차에 시간이 걸리는 만큼 소비자 보호 등을 목적으로 잠정적으로 이노톡스의 제조ㆍ판매 중지를 명령했다. 아울러 의료인과 건강보험심사평가원 및 관련 단체에 안전성 속보를 배포해 즉각적인 사용 중지를 요청했다.
앞서 식약처는 지난 6월 25일부터 메디톡신 50단위, 메디톡신 100단위, 메디톡신 150단위 등 3개 품목의 허가를 취소한다고 결정했다. 식약처는 메디톡스가 메디톡신을 생산하면서 허가 내용과 다른 원액을 사용했음에도 허가된 원액으로 생산한 것처럼 서류를 조작했다고 판단했다. 지난달 13일에는 국가출하승인을 받지 않고 판매한 혐의로 메디톡신 200단위와 코어톡스도 품목허가 취소처분을 내렸다.
메디톡스는 식약처의 처분에 반발해 허가취소 처분의 집행정지와 함께 허가취소 취소 소송을 진행했다. 메디톡스는 지난 6월 허가취소 처분을 받은 메디톡신 3개 품목과 최근 허가취소 처분을 받은 메디톡신과 코어톡스 건에 대해 집행정지 인용을 받아내 본안 판결 후 30일까지 품목허가 취소처분이 중지됐다.

![긁어 부스럼 만든 발언?…‘티아라 왕따설’ 다시 뜨거워진 이유 [해시태그]](https://img.etoday.co.kr/crop/140/88/2100644.jpg)
![잠자던 내 카드 포인트, ‘어카운트인포’로 쉽게 조회하고 현금화까지 [경제한줌]](https://img.etoday.co.kr/crop/140/88/2100528.jpg)
![[단독]"한 번 뗄 때마다 수 백만원 수령 가능" 가짜 용종 보험사기 기승](https://img.etoday.co.kr/crop/140/88/2100020.jpg)
![8만 달러 터치한 비트코인, 연내 '10만 달러'도 넘보나 [Bit코인]](https://img.etoday.co.kr/crop/140/88/2100256.jpg)

![환자복도 없던 우즈베크에 ‘한국식 병원’ 우뚝…“사람 살리는 병원” [르포]](https://img.etoday.co.kr/crop/140/88/2099863.jpg)





!["한국은 '이것' 가능한 유일무이한 국가" 방산주 '이렇게' 투자할 때입니다 ㅣ 이영훈 이사 [찐코노미]](https://i.ytimg.com/vi/B9X9jpK5FGE/mqdefault.jpg)










![[찐코노미] "한국은 이것 가능한 유일무이한 국가"…방산주 '이렇게' 투자할 때](https://img.etoday.co.kr/crop/300/170/2100715.jpg)
![코스피 1% 이상 하락... 2531.66에 마감 [포토]](https://img.etoday.co.kr/crop/300/190/2100641.jpg)