올해는 국내제약기업들의 글로벌 신약 성과가 뜸한 한 해로 기록될 전망이다. 지난 몇 년과는 달리 대규모 기술수출 계약 소식이 많지 않았다. 일부 기술수출 과제의 반환 소식이 있었지만 한미약품의 수출 신약이 속속 후속 개발단계에 진입하며 불확실성을 해소했고 바이오시밀러의 약진이 두드러졌다는 점은 고무적이다. 국내 개발신약도 2건 배출됐다.
◇한올바이오, 바이오신약 中 수출..녹십자ㆍ유한 등 해외진출 지연
18일 업계에 따르면 올해 주목할만한 신약 기술수출 성과는 한올바이오파마의 바이오신약 기술이전이 꼽힌다. 한올바이오파마는 지난 9월 중국 항체개발 전문기업 하버바이오메드와 항체신약 ‘HL161’과 안구건조증치료제 ‘HL036’의 기술이전 계약을 체결했다.

HL161은 자기 신체를 공격해 자가면역질환을 일으키는 병원성 자가항체(pathogenic autoantibody)를 분해 제거하는 새로운 작용기전의 항체신약이다. 안구건조증치료제 HL036은 한올이 대웅제약과 공동으로 개발하고 있는 바이오베터 제품으로 점안액과 같이 국소 적용에 적합하도록 분자 개량된 항TNF 단백질이다.
한올바이오파마 이외에는 대형 기술수출 계약이 눈에 띄지 않았다는 점이 다소 아쉬운 대목이다. 지난해 한미약품, 동아에스티, 코오롱생명과학 등이 연이어 성과를 낸 것과는 대조적이다.
올해에도 기존 수출 신약의 권리 반환 악재도 등장했다.
동아에스티는 지난달 엘러간으로부터 에보글립틴의 기술수출 계약에 대해 종료를 통보받았다. 동아에스티는 지난해 4월 토비라와 총 6150만달러 규모의 에보글립틴의 기술 수출 계약을 맺었다. 에보글립틴은 국내에서 슈가논이라는 제품명으로 출시된 당뇨신약이다. 이 계약은 에보글립틴을 당뇨치료제가 아닌 NASH 치료제 용도로 슈가논의 상업화를 시도하는 내용이다. 이후 토비라는 지난해 9월 엘러간에 인수됐고 엘러간은 에보글립틴의 NASH치료제 개발을 중단키로 결정했다.
녹십자의 혈액제제 ‘아이비글로불린-에스엔’(IVIG-SN)의 미국 진출도 올해를 넘길 전망이다. IVIG-SN은 선천성 면역결핍증, 면역성 혈소판 감소증 등 다양한 용도로 사용되는 녹십자의 간판 혈액분획제제 중 하나다.
녹십자는 지난 2015년 11월 미국 식품의약품국(FDA)에 IVIG-SN의 품목허가를 신청했다. 당초 지난해 말 미국 허가가 예상됐지만 지난해 11월 제조공정 관련 보완사항을 지적받아 허가가 보류됐다. 녹십자는 FDA의 지적사항을 보완한 허가 재신청서를 올해 말 또는 내년 초 제출할 것으로 예상된다. 녹십자는 지난 10월 몬트리올에 약 2200억원을 투입한 대규모 혈액제제 공장을 준공하고 북미 시장 공략을 위한 거점을 마련한 상태다.

유한양행이 중국제약사 뤄신과 계약을 해지한 항암신약 ‘YH25448'의 해외 시장 재도전도 아직 성사되지 않았다. 유한양행은 지난해 7월 전임상시험을 진행 중이던 ‘YH25448'의 중국내 개발, 허가, 생산 및 상업화에 대한 독점적 권리를 넘기는 기술 이전 계약을 체결했다. 뤄신으로부터 계약금(Upfront Payment) 600만달러를 받고 개발 및 상업화에 따른 단계별 기술수출료(마일스톤) 1억2000만달러를 받는 조건이다. YH25448은 3세대 상피세포성장인자 수용체(EGFR)억제제다 .
하지만 유한양행은 “뤄신이 세부계약사항 합의를 앞두고 성실한 협상에 임하지 않았다”며 지난해 말 기술이전 계약을 해지했다. 유한양행은 YH25448의 후속 임상시험 결과를 토대로 해외 무대를 다시 두드리겠다는 복안이다.
◇한미약품, 기술수출 신약 속속 후속임상 진입..SK, 혈우병치료제 美 이어 유럽 진출
제약사들이 기존에 기술수출한 신약 제품들은 순항하며 상업화 단계에 조금씩 다가갔다.

한미약품이 얀센에 기술수출한 당뇨비만치료제 ‘JNJ-64565111’(한미 과제명 HM12525A)은 지난해 말 임상1상시험을 진행하다 임상용 의약품 공급이 차질이 생기면서 임상이 중단됐지만 지난 6월 새로운 임상시험이 재개됐다.
지난달 말에는 사노피에 기술수출한 ‘에페글레나타이드’의 임상3상시험이 시작됐다. 지난 2015년 11월 기술이전 계약을 맺은 이후 2년 만에 후속임상 단계에 진입했다. 당초 지난해 3분기 임상3상시험이 착수 예정이었지만 생산 지연으로 임상 일정이 미뤄지다 후속 임상시험 일정이 확정됐다.
에페글레나타이드는 GLP-1 계열의 당뇨치료제로, 매일 맞던 주사를 주 1회에서 최장 월 1회까지 연장한 바이오신약이다. JNJ-64565111와 에페글레나타이드 모두 한미약품 기반 기술인 ‘랩스커버리’가 적용된 약물이다. 랩스커버리는 바이오의약품의 짧은 반감기를 늘려주는 플랫폼 기술로 투여 횟수 및 투여량을 감소시켜 부작용은 줄이고 효능은 개선하는 기술이다.
한미약품이 지난 2012년 스펙트럼에 기술수출된 호중구감소증치료제 ‘롤론티스’도 글로벌 데뷔가 임박했다. 롤론티스는 기존 호중구감소증치료제의 약효 지속 시간을 늘린 약물이다. 한미약품은 롤론티스의 임상1상시험을 마치고 기술이전했고 스펙트럼은 2015년 말부터 임상3상시험을 진행 중이다. 스펙트럼은 2018년 1분기에 롤론티스의 1차 임상3상 결과를 발표하고 내년 중 허가 신청을 제출할 계획이다.
한미약품이 2015년 3월 스펙트럼에 기술수출한 항암제 ‘포지오티닙’은 연구 과정에서 유전자 엑손(exon) 20에 변이가 생긴 비소세포폐암 종양모델에 획기적인 효과가 있을 것이란 잠재력을 발견하고 폐암치료제 개발을 위한 임상시험을 진행 중이다. 최근 스펙트럼은 포지오티닙의 임상 대상을 비소세포폐암 'EGFR exon 20' 돌연변이에서 'HER2 exon 20' 돌연변이까지 확대하는 임상2상시험에 돌입했다.
앱스틸라는 기존 3세대 치료제의 장점을 취하면서도 제8인자를 구성하는 유전자의 결합방식을 변경해 더욱 높은 생산성을 지니면서도 환자 편의성을 높인 4세대 약물로 평가받는다.
◇셀트리온ㆍ삼성바이오, 바이오시밀러 유럽 허가..수출 실적 급증
올해 국내기업들의 신약 해외성과는 기근을 보인 가운데 바이오시밀러 제품들의 약진이 돋보였다.
램시마의 경우 영국, 프랑스 등 유럽 국가에서 매 분기 판매량이 크게 증가하고 있으며 지난 2분기 46%(IMS헬스 자료 기준)의 시장점유율을 달성하며 성장세를 유지하고 있다.
화이자가 판매 중인 미국에서도 출시 3분기 만에 시장 점유율 4.9%를 기록하며 순항 중이다. 화이자의 3분기 실적을 보면 램시마의 올해 누적 매출은 7400만달러(약 830억원)로 연 매출 1000억원을 예약했다.
셀트리온헬스케어는 올해 3분기까지 램시마와 트룩시마의 수출 실적 5024억원을 기록했다.
셀트리온의 ‘허셉틴’ 바이오시밀러 ‘허쥬마’는 최근 유럽의약품청(EMA) 산하 약물사용자문위원회(Committee for Medicinal Products for Human Use, CHMP)로부터 ‘허가승인 권고’ 의견을 받고 내년 유럽 진출을 예약했다. 허쥬마는 지난 7월 FDA에도 허가 신청이 접수됐다.
셀트리온에 이어 삼성바이오에피스도 해외 시장에서 본격적인 성과를 내기 시작했다.
삼성바이오에피스는 올해 들어 란투스(루수두나 1월), 휴미라(임랄디 8월), 허셉틴(온트루잔트 11월) 등 2종의 바이오시밀러 제품이 유럽 관문을 통과했다. 지난해 엔브렐 바이오시밀러 '베네팔리', 레미케이드 바이오시밀러 '플릭사비'를 허가받은데 이어 총 5개 제품의 유럽 허가를 획득했다.
미국 시장에서는 레미케이드 바이오시밀러 ‘렌플렉시스’와 란투스 바이오시밀러 ‘루수두나’(잠정 승인)가 허가받았다. 국내에서는 지난 2015년 12월 ‘엔브렐’ 바이오시밀러 ‘브렌시스’의 판매를 시작했고 지난해 7월 ‘레미케이드’ 바이오시밀러 ‘렌플렉시스’를 발매했다. 최근 휴미라 바이오시밀러 ‘하드리마’와 허셉틴 바이오시밀러 ‘삼페넷’의 허가를 받았다.
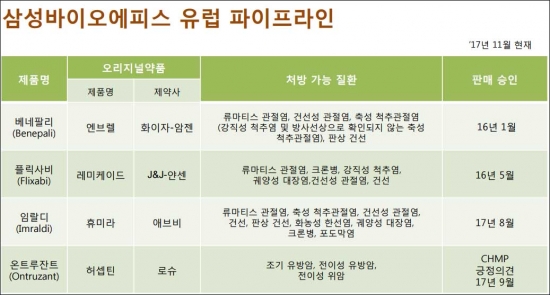
삼성바이오에피스 바이오시밀러 제품들의 상업적 성공 가능성도 제시됐다. 삼성바이오에피스는 올해 3분기 누계 매출 2073억원을 기록했는데 바이오젠이 새 유럽에서 판매 중인 베네팔 리가 올해 3분기까지 2억5320만달러(약 2800억원)의 매출을 기록했다. 다만 플릭사비는 올해 3분기 누적 매출은 470만달러(약 52억원)로 아직 미미한 수준이다.
◇일동ㆍ코오롱생과, 신약 국내 허가..내년 상업적 성패 분수령
국내에서는 올해 2종의 신약이 데뷔했다.
일동제약은 지난 5월 만성B형간염치료제 ‘베시보’의 국내 시판승인을 받으며 1941년 창립 이후 76년만에 첫 신약을 배출했다.

베시보는 국내 기술로 개발한 최초의 뉴클레오타이드계열 만성B형간염치료제로 시장 점유율 1위 ‘비리어드’와 비교한 48주 임상3상시험에서 동등한 수준의 치료효과를 입증했다. 베시보는 약가협상을 거쳐 지난 10월 발매됐다.
인보사케이는 기존 치료 방법인 수술법 또는 약물치료 방법과는 달리 주사제를 통해 통증 및 기능, 관절 구조 개선의 효과를 나타내는 퇴행성관절염 치료제다. 1회 주사로 2년 이상의 통증 완화 및 활동성 증가 효과를 확인한 바이오신약이다. 인보사케이는 발매 한 달 만에 시술 100건을 돌파하며 순조로운 출발을 했다고 회사 측은 평가했다.
베시보와 인보사케이는 내년부터 본격적인 상업적 성공에 대한 시험대에 오를 것으로 예상된다.
베시보의 경우 우수한 효과에도 불구하고 제한적인 처방영역(신규 환자만 건강보험급여 적용)과 100개 이상의 경쟁약물(바라크루드, 비리어드) 제네릭의 등장이라는 난관을 넘어야 한다. 인보사케이는 유전자치료제라는 생소함과 비싼 가격이 변수다. 인보사케이는 ‘통증 완화’ 용도로 허가받았는데, 향후 후속 임상시험을 통해 연골 재생을 통한 구조개선을 입증하면 폭발적인 성장이 기대된다.

![긁어 부스럼 만든 발언?…‘티아라 왕따설’ 다시 뜨거워진 이유 [해시태그]](https://img.etoday.co.kr/crop/140/88/2100644.jpg)
![잠자던 내 카드 포인트, ‘어카운트인포’로 쉽게 조회하고 현금화까지 [경제한줌]](https://img.etoday.co.kr/crop/140/88/2100528.jpg)
![[단독]"한 번 뗄 때마다 수 백만원 수령 가능" 가짜 용종 보험사기 기승](https://img.etoday.co.kr/crop/140/88/2100020.jpg)
![8만 달러 터치한 비트코인, 연내 '10만 달러'도 넘보나 [Bit코인]](https://img.etoday.co.kr/crop/140/88/2100256.jpg)

![환자복도 없던 우즈베크에 ‘한국식 병원’ 우뚝…“사람 살리는 병원” [르포]](https://img.etoday.co.kr/crop/140/88/2099863.jpg)
















![[찐코노미] "한국은 이것 가능한 유일무이한 국가"…방산주 '이렇게' 투자할 때](https://img.etoday.co.kr/crop/300/170/2100715.jpg)
![코스피 1% 이상 하락... 2531.66에 마감 [포토]](https://img.etoday.co.kr/crop/300/190/2100641.jpg)