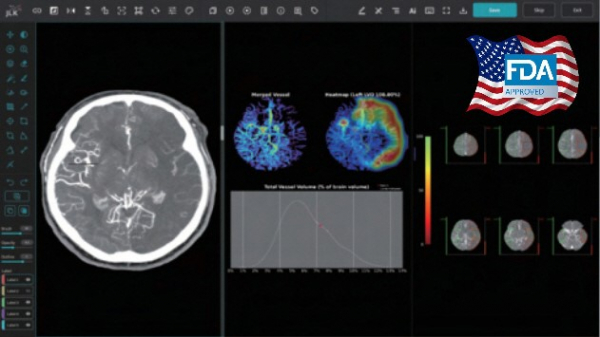
제이엘케이는 자사가 개발한 AI 뇌졸중 솔루션 JLK-LVO(JBS-LVO)가 미국 식품의약국(FDA) 510(k) 승인을 획득했다고 2일 발표했다.
이번 승인은 제이엘케이가 보유한 뇌졸중 솔루션 중 첫 FDA 승인이다. 회사 측은 다른 뇌졸중 솔루션들의 인허가 승인에도 속도가 붙을 것으로 전망했다. 제이엘케이는 이번 승인된 JLK-LVO 외에도 JLK-CTP, JLK-PWI의 FDA 인허가 신청을 완료한 상태다.
그중 총 3개의 솔루션을 추가 신청해 총 6개의 솔루션의 FDA 인허가 신청을 올해 안에 마무리한다는 계획이다. 이 중 2~3개의 뇌졸중 솔루션은 올해 내 FDA 추가 승인도 목표하고 있다.
JLK-LVO는 CT 뇌혈관 영상을 분석해 대혈관폐색(LVO)을 신속하게 검출하는 인공지능 기반 솔루션이다. CT 뇌혈관 영상을 분석한 뒤 의사에게 알람을 보내 수술 여부를 결정한다. 회사 측에 따르면 해당 솔루션은 FDA 승인을 위해 진행한 미국 데이터 임상시험에서도 높은 성능을 보였다.
또 미국 경쟁사 LVO 제품의 미국 NTAP 보험수가가 국내보다 약 80배 높은 회당 1040 달러(약 140만 원)로 책정돼 있어 시장성도 뛰어난 것으로 알려졌다. 제이엘케이는 이번 JLK-LVO FDA 최종 승인으로 미국 보험 수가 시장도 적극적으로 진입해 매출과 이익을 극대화한다는 방침이다.
김동민 제이엘케이 대표는 “이번 FDA 승인은 제이엘케이가 자체적으로 구축한 FDA 인허가 시스템의 유효성을 입증한 중요한 성과”라면서 “계획된 FDA 인허가를 충실히 수행하고 미국을 시작으로 글로벌 시장 진출을 본격화할 예정이다. 뇌졸중 솔루션의 신속한 인허가와 상용화를 통해 더 많은 환자에게 도움이 될 수 있도록 최선을 다하겠다”라고 말했다.

![어떤 주담대 상품 금리가 가장 낮을까? ‘금융상품 한눈에’로 손쉽게 확인하자 [경제한줌]](https://img.etoday.co.kr/crop/140/88/2101515.jpg)
![2025 수능 시험장 입실 전 체크리스트 [그래픽 스토리]](https://img.etoday.co.kr/crop/140/88/2101156.jpg)
!["최강야구 그 노래가 애니 OST?"…'어메이징 디지털 서커스'를 아시나요? [이슈크래커]](https://img.etoday.co.kr/crop/140/88/2101671.jpg)


















![[찐코노미] 美 취약점을 파고든 K방산의 미래…차기 방산 대장주는 '이것'?](https://img.etoday.co.kr/crop/300/170/2101653.jpg)
![예결위, 비경제부처 예산심사 첫날 [포토]](https://img.etoday.co.kr/crop/300/190/2101714.jpg)