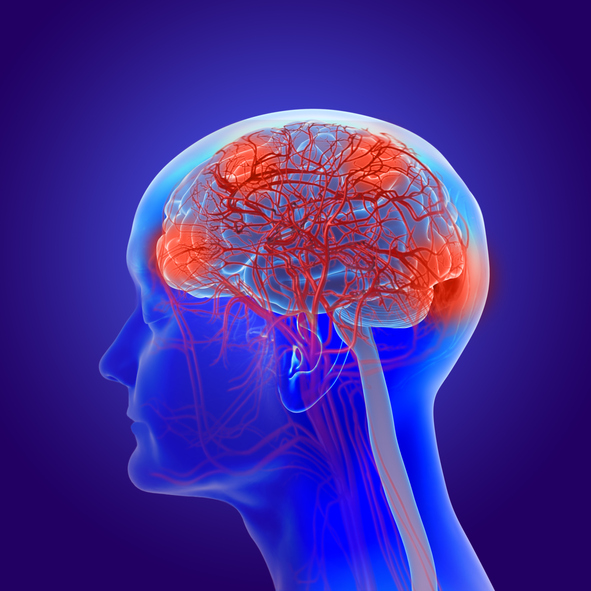
'100세 시대의 재앙'으로 불리는 치매를 정복하기 위한 국내 기업들의 노력이 이어지고 있다. 글로벌 제약사들도 줄줄이 고배를 마신 알츠하이머병 치료제 개발에서 K-바이오의 저력이 발휘될지 관심을 끈다.
8일 업계에 따르면 젬백스앤카엘은 'GV1001'의 알츠하이머병 환자 대상 임상 2상의 최종 결과를 담은 논문의 막바지 작업에 들어갔다.
젬백스는 2017년 8월부터 2019년 9월까지 한양대 구리병원을 포함한 국내 12개 의료기관에서 중등도에서 중증의 알츠하이머병 환자 중 콜린성 신경계 조절 약물인 도네페질을 3개월 이상 안정적으로 복용한 환자를 대상으로 GV1001 0.56mg 또는 1.12mg을 6개월간 피하 투여해 그 안전성과 유효성을 평가하는 임상시험을 실시했다.
회사는 지난 4월 해당 임상의 성공적인 톱라인 결과를 발표했다. 중등도 이상의 알츠하이머병 임상시험에서 가장 보편적으로 쓰이는 중증장애점수(SIB)에서 GV1001을 투여한 두 군 모두 명확한 유의미한 결과를 보였다. 특히 도네페질을 단독 투여한 대조군에서는 SIB점수가 7.23점 감소했지만 GV1001 1.12mg을 투여한 시험군에서는 0.12점의 감소에 그쳐 대조군 대비 탁월한 개선 효과를 확인했다. 이런 성과에 힘입어 최종 결과에 관한 관심도 시간이 지날수록 커지고 있다.
젬백스 관계자는 "논문 작업을 마무리하고 최대한 이른 시일 내 발표하겠다"고 말했다.
메디포스트의 알츠하이머병 줄기세포 치료제 '뉴로스템'은 임상 1/2a상에서 통계적 유의성 달성에 실패해 아쉬움을 남겼다.
올해 초 종료된 이번 임상은 뉴로스템과 위약을 오마야 리저버(Ommaya reservoir)를 통해 뇌실 내 각각 4주 간격으로 3회 투여했다. 24주 관찰 기간을 거쳐 안전성과 탐색적 유효성을 평가했다. 그 결과 1차 유효성 평가 변수인 ADAS-Cog의 변화량 평가변수에서 통계적 유의성을 확인하지 못했다.
다만, 관찰 결과 이상사례는 대부분 경증이며 투여 독성도 발생하지 않아 안전성과 내약성은 양호한 것으로 나타났다. 일시적으로 뇌척수액에서 아밀로이드 베타와 타우 수치 등이 감소했고, 투여 후 24주째 관찰에서도 아밀로이드 침착이 위약군 대비 감소하는 경향을 확인했다.
뉴로스템은 제대혈(탯줄 내 혈액) 유래 간엽줄기세포를 이용한 알츠하이머병 치료제다. 아밀로이드 베타 감소, 타우 단백질의 과인산화 차단 등의 작용으로 신경세포 사멸을 억제해 알츠하이머병 치료하는 것을 목표로 개발 중이었다.
메디포스트는 임상을 재설계해 알츠하이머병 치료제 개발을 이어갈 계획이다. 회사 관계자는 "적절한 질병단계 및 평가기간 설정, 효능 강화 등을 보완한 새로운 임상을 검토하고 있다"고 말했다.
아이큐어는 알츠하이머병 개량신약인 도네페질 패치제의 국내 임상 3상 종료가 임박했다. 회사는 연내 식품의약품안전처 품목허가를 신청, 내년 하반기 제품을 출시하는 것이 목표다. 한국과 유럽, 러시아에 이어 미국 특허 등록도 완료했다.
패치제는 부작용이 적고, 복약 편의성이 높아 경구용보다 환자 선호도가 높다. 아이큐어는 10월까지 미국 식품의약국(FDA)에도 1상 임상시험계획(IND)을 제출할 계획이다. 미국은 505(b)2 트랙(개량신약 허가 프로세스)을 통해 임상 1상 완료 후 바로 품목허가 신청이 가능하다.
알츠하이머병 신약은 임상 3상에 진입하는 것만으로도 수조 원 이상의 가치를 평가받는다. 현재까지 전 세계적으로 근본적인 치료제가 없기 때문이다.
중앙치매센터에 따르면 국내 치매 환자 수는 2018년 기준 75만 명이며, 이중 약 72.5%가 알츠하이머성 치매를 앓고 있는 것으로 추정된다. 세계 알츠하이머 보고서는 치매 관련 비용이 2030년 2조 달러(2400조 원)에 이를 것으로 예상했다.

![어떤 주담대 상품 금리가 가장 낮을까? ‘금융상품 한눈에’로 손쉽게 확인하자 [경제한줌]](https://img.etoday.co.kr/crop/140/88/2101515.jpg)
![2025 수능 시험장 입실 전 체크리스트 [그래픽 스토리]](https://img.etoday.co.kr/crop/140/88/2101156.jpg)
!["최강야구 그 노래가 애니 OST?"…'어메이징 디지털 서커스'를 아시나요? [이슈크래커]](https://img.etoday.co.kr/crop/140/88/2101671.jpg)



















![[정치대학] 박성민 "尹대통령, 권위와 신뢰 잃었다"](https://img.etoday.co.kr/crop/300/170/2101600.jpg)
![예결위, 비경제부처 예산심사 첫날 [포토]](https://img.etoday.co.kr/crop/300/190/2101714.jpg)